Micobacteriosis porcina por miembros del complejo avium: Importancia, diagnóstico e identificación de las posibles fuentes de infección
El complejo Mycobacterium avium engloba dos especies de gran importancia, M. intracellulare y M. avium, la última de las cuales está dividida en cuatro subespecies (M. avium subsp. avium, M. avium subsp. paratuberculosis, M. avium subsp. hominissuis y M. avium subsp. silvaticum). Todas ellas se caracterizan por tener un amplio espectro de hospedadores susceptibles de ser infectados. Además, mientras que algunas de estas especies/subespecies son patógenas estrictas y se encuentran con poca frecuencia fuera de un hospedador (M. avium subsp. avium, M. avium subsp. paratuberculosis, M. avium subsp. silvaticum) otras son bacterias saprofitas capaces de sobrevivir en el medio ambiente y con una amplia distribución en el mismo (M. intracellulare y M. avium subsp. hominissuis). Estas últimas suelen originar procesos infecciosos menos graves en los hospedadores, aunque pueden causar cuadros clínicos severos y la aparición de lesiones macroscópicas en situaciones específicas (fundamentalmente en hospedadores inmunocomprometidos o en situaciones de estrés). En este sentido el complejo avium tiene una gran relevancia a nivel de Salud Pública, importancia que ha aumentado considerablemente en las últimas décadas debido a la combinación de una serie de factores: por una parte, la aparición del VIH, el progresivo envejecimiento de la población en los países desarrollados y el incremento en el uso de terapias inmunosupresoras, han aumentado la población inmunodeprimida y por tanto susceptible a estas bacterias (Falkinham, III, 2003b); por otra, la creciente implantación a nivel mundial de tratamientos potabilizadores del agua puede producir una selección positiva de bacterias resistentes a la cloración, como los miembros del complejo avium (Falkinham, III, 2003a; Primm etal., 2004).
En lo que hace referencia a la importancia de estas bacterias en la especie porcina, son fundamentalmente dos de sus miembros los que han sido descritos con mayor frecuencia como agentes patógenos de cierta relevancia:
M. avium susbp. avium: Es la especie causal de la tuberculosis aviar, por lo que se considera que las aves son su hospedador preferente, aunque también puede infectar otras especies. Así, se ha aislado de un gran número de especies animales incluyendo ciervos, ovejas, vacas, roedores, cerdos y seres humanos. Sin embargo en el caso de cerdos y en el hombre normalmente el porcentaje de hallazgos de esta subespecie es inferior al de los de M. avium subsp. hominissuis. Al ser esta especie un patógeno estricto la posibilidad de que los animales se infecten a partir del medio ambiente es más reducida.
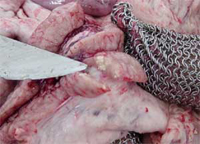
© Cedida por Alejandro Skoknic
M. avium subsp. hominissuis: Es sin duda la subespecie más heterogénea de M. avium, ya que la aplicación de técnicas de caracterización molecular detecta una mayor variabilidad en ella comparada con los patógenos estrictos M. avium subsp. avium y M. avium subsp. paratuberculosis. Su impacto más relevante se da en la especie porcina, donde puede originar lesiones granulomatosas, fundamentalmente en los linfonodos situados en la cabeza y mesentéricos. A pesar de que los cerdos no muestran signos clínicos, el hallazgo de estas lesiones en el matadero puede dar lugar a un importante descenso en el valor económico del animal, habiéndose descrito casos en todos los continentes. La ubicación de las lesiones indica que la vía de infección es normalmente oral, aunque se han descrito lesiones circunscritas a linfonodos bronquiales.
En situaciones de brotes por estos patógenos es fundamental el aislamiento bacteriológico del agente causal, ya que el aspecto macroscópico de las lesiones a las que dan lugar las bacterias de ambas subespecies puede confundirse, entre otros agentes patógenos, con las producidas por los miembros del complejo Mycobacterium tuberculosis, agentes causales de la tuberculosis humana y animal, zoonosis de gran importancia a nivel de Salud Pública y Sanidad Animal. Por ello el cultivo in-vitro del agente causal del brote es la única manera de confirmar de forma inequívoca la presencia de las cepas del complejo avium implicadas.
La ubicuidad de algunos de los miembros del complejo avium hace que en ocasiones sea difícil establecer con seguridad cuál es la procedencia de la infección en el ganado porcino, ya que normalmente existen varias potenciales fuentes de infección. La única forma de establecer con seguridad el origen del brote es la realización de un estudio epidemiológico en busca de factores de riesgo que hayan podido dar lugar al proceso; posteriormente, debe realizarse el cultivo bacteriológico del agente implicado a partir de las posibles fuentes de infección, para después proceder a la comparación mediante técnicas de biología molecular del agente ambiental y del aislado en el proceso clínico de los animales. El cultivo de estas bacterias debe realizarse empleando medios de cultivo específicos.
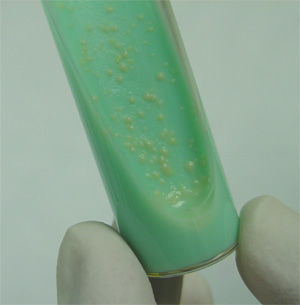
La identificación y comparación de aislados procedentes de muestras clínicas y cepas ambientales puede realizarse empleando varios métodos, normalmente basados en el análisis del material genético de las bacterias. En algunos casos se emplean secuencias de inserción específicas de especie o subespecie (en el complejo avium se emplean con frecuencia IS901 e IS1245) (Kunze et al., 1991); (Guerrero et al., 1995) o el análisis de determinadas secuencias polimórficas entre subespecies y/o aislados [entre ellos el gen que codifica la proteína resistente al calor hsp65 (Turenne et al., 2006) y ciertos polimorfismos de secuencia larga (Semret et al., 2006)]. También se puede realizar un análisis de números variables de repetición en tándem o VNTRs (Variable Number of Tandem Repeats), basados en la detección y cuantificación de repeticiones en tándem: una repetición en tándem es una secuencia corta de ADN de 14 a 100 nucleótidos normalmente que se repite consecutivamente (de 4 a 40 veces), en un locus específico (Bull et al., 2003; Thibault et al., 2007); el número de unidades repetidas puede variar en distintas cepas, y por tanto la determinación de ese número de repeticiones puede ser una herramienta para la caracterización de aislados.
Las técnicas que tienen un mayor poder de discriminación a la hora de comparar aislados para clarificar si tienen relación epidemiológica son aquellas basadas en el análisis de una proporción mayor del cromosoma bacteriano. Entre ellas podemos citar el Análisis mediante Electroforesis en Campo Pulsado o PFGE (Pulsed Field Gel Electrophoresis): esta técnica está basada en el análisis de todo el cromosoma bacteriano después de ser sometido a una digestión enzimática. Así, el ADN de la bacteria se embebe en bloques de agarosa y posteriormente se somete a un protocolo de lisis química para liberar el ADN, que queda distribuido de forma homogénea por los bloques. Se aplica entonces la enzima de restricción de elección (de puntos de corte infrecuentes) y se aplica una electroforesis multidireccional sobre el ADN digerido durante un periodo de tiempo determinado. Mediante la electroforesis de campo pulsado pueden separarse fragmentos de gran tamaño (hasta 10Mb) que darán lugar a perfiles característicos, mientras que con la electroforesis convencional no pueden separarse bandas de más de 50kb. Así, los distintos patrones de bandas son consecuencia de fenómenos genéticos tales como mutaciones que crean o eliminan puntos de corte de la enzima, o inserciones o deleciones que incrementan o disminuyen el tamaño de una banda.
La aplicación de estas técnicas ha permitido la identificación inequívoca de la fuente de infección en brotes de micobacteriosis en porcino en diversos estudios (Matlova et al., 2004; Matlova et al., 2005). Conviene destacar la importancia de las colonizaciones por micobacterias del complejo avium en el serrín empleado para las camas de los lechones, en los sistemas de canalización de agua y en los equipos de enfriamiento del aire como importantes factores de riesgo que pueden contribuir a la aparición de un brote por estas bacterias.
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Bibliografía
Bull, T. J., Sidi-Boumedine, K., McMinn, E. J., Stevenson, K., Pickup, R., y Hermon-Taylor, J. (2003). Mycobacterial interspersed repetitive units (MIRU) differentiate Mycobacterium avium subspecies paratuberculosis from other species of the Mycobacterium avium complex. Mol.Cell.Probes 17, 157-164.
Falkinham, J. O., III (2003a). Factors influencing the chlorine susceptibility of Mycobacterium avium, Mycobacterium intracellulare, and Mycobacterium scrofulaceum. Appl.Environ.Microbiol. 69, 5685-5689.
Falkinham, J. O., III (2003b). The changing pattern of nontuberculous mycobacterial disease. Can.J.Infect.Dis. 14, 281-286.
Guerrero, C., Bernasconi, C., Burki, D., Bodmer, T., y Telenti, A. (1995). A novel insertion element from Mycobacterium avium, IS1245, is a specific target for analysis of strain relatedness. J.Clin.Microbiol. 33, 304-307.
Kunze, Z. M., Wall, S., Appelberg, R., Silva, M. T., Portaels, F., y McFadden, J. J. (1991). IS901, a new member of a widespread class of atypical insertion sequences, is associated with pathogenicity in Mycobacterium avium. Mol.Microbiol. 5, 2265-2272.
Matlova, L., Dvorska, L., Ayele, W. Y., Bartos, M., Amemori, T., y Pavlik, I. (2005). Distribution of Mycobacterium avium complex isolates in tissue samples of pigs fed peat naturally contaminated with mycobacteria as a supplement. J.Clin.Microbiol. 43, 1261-1268.
Matlova, L., Dvorska, L., Palecek, K., Maurenc, L., Bartos, M., y Pavlik, I. (2004). Impact of sawdust and wood shavings in bedding on pig tuberculous lesions in lymph nodes, and IS1245 RFLP analysis of Mycobacterium avium subsp. hominissuis of serotypes 6 and 8 isolated from pigs and environment. Vet.Microbiol. 102, 227-236.
Primm, T. P., Lucero, C. A., y Falkinham, J. O., III (2004). Health Impacts of Environmental Mycobacteria. Clin.Microbiol.Rev. 17, 98-106.
Semret, M., Turenne, C. Y., de Haas, P., Collins, D. M., y Behr, M. A. (2006). Differentiating host-associated variants of Mycobacterium avium by PCR for detection of large sequence polymorphisms. J.Clin.Microbiol. 44, 881-887.
Thibault, V. C., Grayon, M., Boschiroli, M. L., Hubbans, C., Overduin, P., Stevenson, K., Gutierrez, M. C., Supply, P., y Biet, F. (2007). New variable-number tandem-repeat markers for typing Mycobacterium avium subsp. paratuberculosis and M. avium strains: comparison with IS900 and IS1245 restriction fragment length polymorphism typing. J.Clin.Microbiol. 45, 2404-2410.
Turenne, C. Y., Semret, M., Cousins, D. V., Collins, D. M., y Behr, M. A. (2006). Sequencing of hsp65 distinguishes among subsets of the Mycobacterium avium complex. J.Clin.Microbiol. 44, 433-440.
Para saber más:
Thorel MF, Huchzermeyer H, Weiss R, Fontaine JJ. Mycobacterium avium infections in animals. Literature review. Vet Res. 1997 Sep-Oct;28(5):439-47.
Thorel MF, Huchzermeyer HF, Michel AL. Mycobacterium avium and Mycobacterium intracellulare infection in mammals. Rev Sci Tech. 2001 Apr;20(1):204-18.


