Los Biofilms y su repercusión en la Industria Alimentaria
Los biofilms se definen como comunidades complejas de microorganismos que crecen embebidos en una matriz orgánica polimérica autoproducida y adherida a una superficie viva o inerte, y que pueden presentar una única especie microbiana o un abanico de especies diferentes (Carpentier y Cerf, 1993; Costerton, 1995; Costerton et al., 1999; Davey y O’Toole, 2000; Kraigsley et al., 2002). Las bacterias que forman el biofilm se hallan en lo que se denomina forma sésil, exhibiendo un fenotipo diferente al de esas mismas células en forma unicelular o libre (forma planctónica) con respecto a la tasa de crecimiento y a la transcripción de genes (Donlan, 2002).
La formación de biofilms es una estrategia adaptativa de los microorganismos, ya que el crecimiento en biofilm ofrece cuatro ventajas importantes: (I) protege a los microorganismos de la acción de los agentes adversos, (II) incrementa la disponibilidad de nutrientes para su crecimiento, (III) facilita el aprovechamiento del agua, reduciendo la posibilidad de deshidratación y (IV) posibilita la transferencia de material genético (ADN). Todas estas circunstancias pueden incrementar sus capacidades de supervivencia. Como consecuencia, los métodos habituales de desinfección o el uso de antibióticos se muestran a menudo ineficaces contra las bacterias del biofilm (Costerton et al., 1999; Donlan, 2002).
Podemos encontrar biofilms en todos los medios donde existan bacterias: en el medio natural, clínico o industrial. Solo se requiere la presencia de un entorno hidratado y una mínima cantidad de nutrientes, ya que pueden desarrollarse sobre todo tipo de superficies (hidrofobas o hidrófilas, bióticas o abióticas) (Kraigsley et al., 2002; Terry et al., 2003). El desarrollo en biofilm es una forma habitual de crecimiento de las bacterias en la naturaleza. En la actualidad se considera que en condiciones ambientales adecuadas, la mayoría los microorganismos son capaces de formar biofilms (Donlan, 2002; Lasa et al., 2009).
Aunque la composición del biofilm es variable en función del sistema de estudio, en general, el componente mayoritario es el agua, que puede representar hasta un 97% del contenido total. Además de agua y de las células bacterianas, la matriz del biofilm es un complejo que está formado principalmente por exopolisacáridos (Sutherland, 2001). En menor cantidad se encuentran otras macromoléculas como proteínas, ADN y diversos productos procedentes de la lisis de las bacterias (Branda et al., 2005).
Estudios realizados utilizando microscopía confocal han mostrado que la arquitectura de la matriz del biofilm no es sólida y presenta canales que permiten el flujo de agua, nutrientes y oxígeno incluso hasta las zonas más profundas del biofilm. La existencia de estos canales no evita sin embargo, que dentro del biofilm se puedan encontrar diferentes ambientes en los que la concentración de nutrientes, pH u oxígeno sea distinta. Esta circunstancia aumenta la heterogeneidad del estado fisiológico en el que se encuentra la bacteria dentro del biofilm y dificulta su estudio (Lasa et al., 2009).
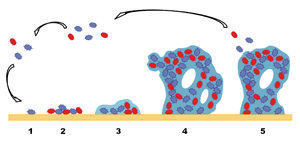
La formación de biofilm es un proceso dinámico y complejo que conlleva la adhesión, colonización y crecimiento de los microorganismos. No se trata de un proceso aleatorio sino que sigue una sistemática que permite su predicción (Kumar y Anand, 1998). En él podemos identificar hasta cinco fases, que se pueden visualizar en la figura 1: (i) una adsorción reversible de la bacteria planctónica a la superficie, (ii) unión irreversible mediante la producción de la matriz polimérica, (iii) una fase inicial de maduración con crecimiento y división del microorganismo, (iv) una etapa posterior de producción del exopolímero y (v) el desarrollo final de la colonia con dispersión de células colonizadoras (Kumar y Anand, 1998).
En la industria alimentaria es muy común la presencia de biofilms en conducciones, equipos y materiales ya que pueden formarse en cualquier tipo de superficie, incluyendo plástico, cristal, madera, metal y sobre los alimentos (Chmielewsky y Frank, 2003).
Puesto que estas formaciones pueden contener microorganismos patógenos y presentan una mayor resistencia a la desinfección, se incrementan las probabilidades de contaminación del producto y de provocar infecciones alimentarias, razón por la que se considera que la presencia de biofilms en las superficies de contacto de la industria alimentaria constituye un evidente riesgo para la salud.
Uno de los principales problemas en la industria alimentaria está representado por la supervivencia de microorganismos patógenos o alterantes debido a una desinfección insuficiente de las superficies o de los instrumentos en contacto con los alimentos. (Carpentier y Cerf, 1993; Fuster i Valls, 2006).
La presencia de biofilms en estas superficies es la causa principal de contaminación del producto final. Las consecuencias de esta contaminación pueden conducir a pérdidas económicas debidas tanto al necesario rechazo del producto como, incluso, a el desarrollo de enfermedades, si intervienen microorganismos patógenos (Piera Serra, 2003). Los biofilms formados sobre las carnes crudas y en el entrono del manipulador (superficies, utillaje e instrumentos…) aumentan considerablemente los problemas de contaminación cruzada y de contaminaciones posteriores en el procesado. Por este motivo es preciso eliminar todos los microorganismos de las superficies en contacto con los alimentos, antes de que los contaminen y establezcan un biofilm que les servirá de reservorio (Piera Serra, 2003; Fuster i Valls, 2006).
Además del riesgo de contaminación, el desarrollo de biofilms puede interferir en diferentes procesos y causar daños en los equipos (Kumar y Anand, 1998; Chmielewski y Frank, 2003). En sistemas de agua potable la formación de biofilms pueden obstruir las cañerías disminuyendo su velocidad y su capacidad de transporte originando un incremento en el consumo energético. La formación de biofilm en intercambiadores de calor y torres de refrigeración puede reducir la transferencia de calor y como consecuencia su eficiencia en el proceso. La formación de biofilms persistentes en las superficies metálicas puede causar corrosión debido a la producción de ácido por parte de las bacterias (Chmielewski y Frank, 2003).
En la industria láctea y en otras industrias alimentarias, se emplean los sistemas de ultrafiltración y de osmosis inversa durante el fraccionamiento de la leche y otros líquidos así como para la clarificación de zumos de frutas. Estos filtros y membranas tienen unos poros de muy pequeño diámetro y están continuamente en contacto con el alimento; la más mínima adsorción microbiana bloquearía los poros y provocaría la colmatación del filtro. Esto produciría una reducción del flujo con las consiguientes pérdidas de rendimiento y de producto (Piera Serra, 2003). Para la prevención de los riesgos y del coste de los daños que causan los biofilms son necesarios procedimientos de limpieza y desinfección efectivos (Silagyi, 2007).
A pesar de que la mayoría de las especies bacterianas tienen la capacidad de formar biofilms, algunos géneros lo forman más fácil y rápidamente que otros, como es el caso de Pseudomonas, Listeria, Enterobacter, Flavobacterium, Alcaligenes, Staphylococcus y Bacillus (Mattila Sandholm y Wirtanen, 1992; Lee Wong, 1998).
Si bien son numerosas las especies susceptibles de formar biofilms en la industria de producción de alimentos se citan a continuación algunas de especial importancia en relación con la seguridad alimentaria (González Ribas, 2005).
Listeria monocytogenes
L. monocytogenes es un patógeno con capacidad de proliferación en entornos fríos y húmedos, ideales para la formación de biofilms tanto mono como multiespecíficos (Chmielewsky y Frank, 2003). Las cepas de Listeria presentan gran facilidad para adherirse a superficies vivas e inertes y requieren solo un corto espacio de tiempo para la unión. Para iniciar la adhesión, utiliza flagelos, pilis y proteínas de membrana. Se ha observado que Listeria muestra mayor adhesión cuando está en la fase de mayor actividad metabólica (Gonzalez Ribas, 2005).
Estudios sobre este patógeno han demostrado que puede llegar a formar biofilm en maquinas loncheadoras y en otros utensilios de acero (Keskinen et al. 2008). Este hecho pone de relevancia los biofilm como un factor de importancia en la contaminación cruzada.
En la industria láctea, Listeria puede encontrarse presente tanto en la leche líquida como en los productos elaborados, pudiendo estar asociada a la aparición de brotes clínicos. Estudios realizados en este tipo de industria demuestran que la presencia de restos de proteínas lácteas en las conducciones reduce la adhesión bacteriana, poseyendo, según algunos autores, una posible capacidad inhibitoria de la formación del biofilm es sus primeras etapas. Sin embargo, una vez instaurado éste, la presencia de residuos lácteos en las conducciones favorece la supervivencia del biofilm ya que supone una fuente de nutrientes para las bacterias (Lee Wong, 1998).
Salmonella spp.
Entre las zoonosis de etiología bacteriana más importantes, la salmonelosis ocupa un lugar destacado, debido tanto a sus múltiples formas clínicas como a las repercusiones que en materia de Salud Pública tiene la aparición de brotes de esta enfermedad. Según datos de la European Food Safety Authority (EFSA), Salmonella spp. es el primer causante de brotes de toxiinfección alimentaria en la UE en los últimos años (EFSA, 2009).
Varios estudios han demostrado que Salmonella se puede adherir y formar biofilms en superficies que se encuentran en las plantas de procesado de alimentos y entre las que se incluyen plástico, cemento y acero (Joseph et al., 2001; Chmielewsky y Frank, 2003). Esto se debe a que posee estructuras de superficie, como la SEF 17 fimbriae, que le facilitan la adhesión a las superficies inanimadas, proporcionando a las células cierta capacidad de resistencia frente a fuerzas mecánicas (Gonzalez Ribas, 2005).
Estudios recientes han demostrado que Salmonella, E. coli y muchas otras enterobacterias producen celulosa como exopolisacárido principal de la matriz del biofilm y que la formación de éste resulta esencial para la supervivencia de la bacteria en el ambiente (Lasa et al., 2009).
Estudios realizados en la industria alimentaria demostraron que existen diferencias entre los distintos serotipos de Salmonella enterica en la facilidad de producir biofilms y en la perdurabilidad de los mismos (Vestby et al., 2009).
Escherichia coli
Para la formación de biofilms, E. coli emplea flagelos, pilis y proteínas de membrana para iniciar la adhesión. Cuando ya está unida a la superficie pierde sus flagelos e incrementa la producción de sustancias poliméricas extracelulares (Gonzalez Ribas, 2005; Houdt y Michiels, 2005). Algunos estudios han puesto de manifiesto que cepas de E. coli O157:H7 pueden desarrollar biofilms como resultado de una mayor producción de expolisacáridos y curli (Ryu et al., 2004). Además, se ha demostrado que la formación de biofilm proporciona una mayor resistencia a E. coli O157:H7 cuando se expone a soluciones de hipoclorito, uno de los desinfectantes de mayor uso en la industria alimentaria (Wilks et al., 2005; Ryu y Beuchat, 2005).
Pseudomonas spp.
Estas bacterias son muy ubicuas y se encuentran en ambientes de procesado de alimentos incluidos desagües, suelos, superficie de carnes, frutas y verduras y productos lácteos de baja acidez (Chmielewsky y Frank, 2003; González Ribas, 2005).
P. aeruginosa es el modelo bacteriano en el que se han realizado la mayoría de los estudios de formación de biofilms y regulación mediante quorum sensing (Golovlev, 2002). Produce una gran cantidad de sustancias poliméricas extracelulares lo que le permite unirse a superficies de materiales inorgánicos, como el acero inoxidable. Dentro del biofilm puede coexistir con Listeria, Salmonella y otros patógenos formando biofilms multiespecíficos mucho más estables y resistentes (Chmielewsky y Frank, 2003; González Ribas, 2005).
Campylobacter jejuni
Aunque Campylobacter no se multiplica en alimentos, su dosis infectiva mínima es muy pequeña, es menor que cualquier otro patógeno. Además, la investigación experimental ha sugerido que Campylobacter puede tener un mayor potencial de diseminación durante la manipulación de alimentos por parte del consumidor que otros patógenos lo que incrementa el riesgo de contaminación cruzada (Joshua et al., 2006; Hanning y Slavik, 2009).
Uno de los mecanismos de supervivencia de Campylobacter spp. en el medio ambiente es la formación de biofilms. Se ha visto que Campylobacter es capaz de producir estas biopelículas tanto en ambientes acuáticos como sobre superficies de acero inoxidable y de cristal. El microambiente creado en el interior del biofilm, protege a C. jejuni de su inactivación por la presencia de oxígeno. Se ha demostrado que esta bacteria en el interior del biofilm es capaz de sobrevivir durante una semana a 10 ºC, con escasos niveles nutritivos y en condiciones atmosféricas normales, a pesar de su sensibilidad a este tipo de ambientes. También, se ha observado que C. jejuni desarrolla biofilms más rápidamente bajo las condiciones aeróbicas más estresantes (20% O2) que en condiciones de microaerofilia (5% O2, 10% CO2), lo que muestra la capacidad de este microorganismo de adaptar las condiciones propias del biofilm en su beneficio, actuando como reservorio de células viables (Reuter et al., 2010). Estos estudios ponen de manifiesto el papel que la formación de biofilms supone para mantener la presencia activa de Campylobacter en los ambientes de procesado de alimentos, aumentando el riesgo de contaminación (Murphy et al., 2006).
Bacillus spp.
Bacillus spp. es capaz desobrevivir durante aquellos procesos que utilizan calor y acumularse en las tuberías y en las juntas de estos entornos de procesado de alimentos. Incluso si los fluidos calientes fluyen continuamente sobre estas superficies durante más de 16 horas, Bacillus y otras bacterias termorresistentes son capaces de formar biofilms (Chmielewsky y Frank, 2003; González Ribas, 2005).
Conclusiones
La presencia de biofilms en la Industria alimentaria puede suponer un importante problema tanto tecnológico como de Salud Pública. Las características propias de esta forma de crecimiento bacteriano, que implica un comportamiento diferente ante los procesos de limpieza y desinfección de las células planctónicas frente a las que se han ensayado la mayoría de los agentes. Por lo tanto, la dificultad existente para eliminar estas formaciones una vez instauradas hace que la prevención sea, una vez más, la estrategia de elección a la hora de controlar este problema.
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Bibliografía
- Branda S.S., Vik S., Friedman L., Kolter R. (2005). Biofilms: the matrix revisited. Trends in Microbiology, 13, pp: 20 26.
- Carpentier, B., Cerf, O. (1993). Biofilms and their consequences with particular references to hygiene in the food industry. Journal of Applied Bacteriology, 75, pp: 499 511.
- Chmielewsky R.A.N., FranK, J.F. (2003). Biofilm formation and control in food processing facilities. Comprehensive Reviews in Food Science and Food Safety, 2, pp: 22 32.
- Costerton J.W., Stewart P.S., Greenberg E.P. (1999). Bacterial Bioflms: a common cause of persistent infections. Science, 284, pp: 1318 1322.
- Costerton J.W. (1995). Overview of microbial biofilms. Journal of Industrial Microbiology, 15, pp: 137 140.
- Davey M.E., O’Toole G.O. (2000). Microbial biofilms: from ecology to molecular genetics. Microbiology and Molecular Biology Reviews, 64 (4) pp: 847 867.
- Donlan R.M. (2002). Biofilms: microbial life on surfaces. Emerging Infectious Diseases, 8 (9), pp: 881 890.
- EFSA (2009). The Community Summary Report on Trends and Sources of Zoonoses and Zoonotic Agents in the European Union in 2007.
- Fuster i Valls N. (2006). Importancia del control higiénico de las superficies alimentarias mediante técnicas rápidas y tradicionales para evitar y/o minimizar las contaminaciones cruzadas.
- Golovlev E.L. (2002). The Mechanism of Formation of Pseudomonas aeruginosa Biofilm, a Type of Structured Population. Microbiology, 71 (3), pp: 249 254.
- González Ribas F. (2005). Desarrollo y aplicación de sensores para evaluar la contaminación microbiológica de superficies domésticas españolas y de la efectividad de desinfectantes in situ de productos limpiadores comerciales.
- Hanning I., Slavik M. (2009). Campylobacter jejuni as a primary colonizig biofilm former. International Journal of Poultry Science, 8 (1), pp: 1 6.
- Houdt R.V., Michiels C.W. (2005). Role of bacterial cell surface structures in Escherichia coli biofilm formation. Research in Microbiology, 156, pp: 626 633.
- Joseph B., Otta S.K., Karunasagar I, Karunasagar I. (2001). Biofilm formation by Salmonella spp. on food contact surfaces and their sensitivity to sanitizers. International Journal of Food Microbiology, 64 pp: 367 372.
- Joshua G.W.P., Guthrie Irons C., Karlyshev A.V. y Wren B.W. (2006). Biofilm formation in Campylobacter jejuni. Microbiology, 152, pp: 387 396.
- Keskinen L.A., Todd E.C.D., Ryser. E. (2008). Transfer of Surface Dried Listeria monocytogenes from Stainless Steel Knife Blades to Roast Turkey Breast. Journal of Food Protection 71, pp: 176 181.
- Kraigsley A., Ronney P.D., Finkel S.E. (2002). Dynamics of self propagating fronts of motile bacteria.
- Kumar C.G., Anand S.K. (1998). Significance of microbial biofilms in food industry: a review. International Journal of Food Microbiology, 42, pp: 9 27.
- Lasa I., del Pozo J.L., Penadés J.R. (2009). Biofilms Bacterianos e infección.
- Lee Wong A.C. (1998). Biofilms in Food Processing Enviroments. Journal of Dairy Science, 81, pp: 2765 2770.
- Mattila Sandholm T., Wirtanen G. (1992). Biofilm formation in the industry: A review. Food Reviews International, 8 (4), pp: 573 603.
- Murphy C., Carroll C., Jordan K.N. (2006). Environmental survival mechanisms of the foodborne pathogen Campylobacter jejuni. Journal of Applied Microbiology, 100, pp: 623 632.
- Piera Serra, G. (2003). Estudio de biofilms: Formación y consecuencia.
- Reuter M., Mallett A., Pearson B.M., van Vliet A.H. (2010). Biofilm formation in Campylobacter jejuni is increased under aerobic conditions. Applied and Environmental Microbiology.
- Ryu J.H., Beuchat L.R. (2005). Biofilm Formation by Escherichia coli O157:H7 on Stainless Steel: Effect of Exopolysaccharide and Curli Production on Its Resistance to Chlorine. Applied and Environmental Microbiology 7, pp: 247 254.
- Ryu J.H., Kim H., Beuchat L.R. (2004). Attachment and biofilm formation by Escherichia coli O157:H7 on stainless steel as influenced by exopolysaccharide production, nutrient availability, and temperature. Journal of Food Protection 67, pp: 2123 2131.
- Silagyi K.S. (2007). Biofilm formation by Escherichia coli O157:H7.
- Sutherland I. (2001). Biofilm exopolysaccharides: a strong and sticky framework. Microbiology, 147, pp: 3 9.
- Terry A., Curtis E. Pantle R., Penny S.A. (2003). Boundaries for Biofilm Formation: Humidity and Temperature. Applied and Environmental Microbiology, 69, pp: 5006 5010.
- Vestby L.K., Møretrø T., Langsrud S., Heir E., Nesse L.L. (2009). Biofilm forming abilities of Salmonella are correlated with persistence in fish meal and feed factories. BMC Veterinary Research, 5:20.
- Wilks S.A., Michels H., Keevil C.W. (2005). The survival of Escherichia coli O157 on a range of metal surfaces International. Journal of Food Microbiology 105, pp: 445 454.


