Fiebre Q: Importancia actual en Europa
La fiebre Q es una de las zoonosis desatendidas más extendida en todo el mundo, a pesar de que se puede considerar como una enfermedad emergente o reemergente en muchos países [1]. La enfermedad ha sido detectada en casi todos los países donde se ha investigado su presencia [2], con la excepción de Nueva Zelanda [3,4]. Sin embargo muchos aspectos de esta enfermedad y de su agente causal, Coxiella burnetii, una bacteria intracelular obligada, siguen sin estar claros a pesar de que en los últimos años se le ha prestado una atención cada vez mayor que podría explicar en parte su “emergencia” (debido al empleo de técnicas de diagnóstico cada vez más sensibles, y a una mayor vigilancia tanto desde el punto de vista de Salud Pública como de Sanidad Animal).
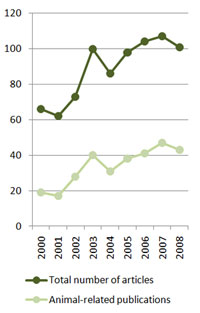
De hecho el número de trabajos científicos dedicados al estudio de la fiebre Q ha aumentado de 66 en el 2000 a 101 el año pasado; de igual forma, el número de artículos sobre C. burnetii en animales se ha doblado en el mismo periodo, de 19 a 43 (Figura 2). Todo ello demuestra el interés cada vez mayor que despierta este patógeno.
En el ser humano la fiebre Q es en la mayoría de los casos un proceso asintomático (60%), si bien en ciertas ocasiones aparece la enfermedad también puede cursar de forma aguda o crónica. En el caso de una presentación aguda, puede cursar de forma similar a una gripe autolimitante, con fiebre elevada de presentación súbita, escalofríos y dolores de cabeza, o bien dar lugar a un cuadro de hepatitis o neumonía [1,2]. La forma de presentación parece verse determinada en parte por la localización geográfica, si bien la razón que explique estas diferencias no ha podido identificarse todavía [5]. En lo que hace referencia a la forma crónica (aquellos casos en los que la infección dura seis meses o más), los órganos afectados son normalmente el corazón, las arterias, los huesos y el hígado, y aparece en un 1-5% de los pacientes infectados (ya sea con síntomas o de forma asintomática) meses o años después de que se haya producido la fase aguda. Las presentaciones más frecuentes en caso de enfermedad crónica son endocarditis (en un elevado porcentaje de los casos con consecuencias fatales), aneurismas vasculares y osteomielitis. Con frecuencia los pacientes con un cuadro de fiebre Q aguda no reciben tratamiento debido a la ausencia de un diagnóstico preciso, aunque cuando es identificada esta enfermedad debería tratarse [6]; los efectos adversos de los tratamientos administrados con mayor frecuencia (principalmente con doxicilina) hacen que los niños y las mujeres gestantes sean pacientes difíciles de tratar [2,7]. En casos crónicos de endocarditis puede ser necesario instaurar tratamientos de por vida con combinaciones de antibióticos y cirugía [6,2].
National Institutes of Health. United States Department of Health and Human Services.
En los rumiantes domésticos la infección es, en la mayoría de los casos, asintomática, salvo por el incremento en las tasas de abortos [8]. Esta presentación inespecífica conlleva que en la mayoría de países la prevalencia real de C. burnetii no haya sido determinada con precisión, y esté con frecuencia subestimada. El microorganismo tiene un amplio rango de hospedadores que incluye mamíferos, aves y artrópodos, y por tanto muchas especies animales (incluyendo la fauna salvaje) pueden actuar como reservorios de esta bacteria. Sin embargo, el ganado está considerado como la principal fuente de infección para el hombre. Los animales infectados excretan cantidades variables de C. burnetii en sus deposiciones, orina y leche, y especialmente durante el aborto o el parto, ya que en estas situaciones se liberan importantes cantidades de la bacteria al ambiente en los fluidos del parto, y en las placentas infectadas. Debido a la elevada resistencia de C. burnetii a condiciones ambientales adversas, puede mantenerse viable durante semanas, y por tanto permanecer infectivo para otros hospedadores en el ambiente. Por ello, la transmisión al humano ocurre normalmente tras la inhalación de aerosoles producidos a partir de material contaminado. C. burnetii tiene una dosis infectiva muy pequeña, y las formas viables de la bacteria pueden diseminarse por la acción del viento, infectando así a pacientes que no han mantenido contacto con animales, lo que dificulta la identificación de la fuente de infección en algunos brotes en el hombre. Aunque esta enfermedad no está considerada como una zoonosis de transmisión alimentaria, también puede transmitirse a través del consumo de leche no pasteurizada, o de subproductos lácteos producidos con ésta. La transmisión a través de la picadura de artrópodos también es posible, aunque en la actualidad no es considerada como una vía relevante en la epidemiología de la enfermedad [2]. Su elevada capacidad de supervivencia y la baja dosis infectiva convierten a C. burnetii en un candidato ideal para su empleo en bioterrorismo, y por ello está incluida en la categoría B de la lista de agentes de bioterrorismo del Centro para el Control y la Prevención de Enfermedades (CDC). El control de la enfermedad en el ganado es complicado debido a la ausencia de tratamientos efectivos o vacunas eficaces. Los antibióticos pueden utilizarse para disminuir la incidencia de abortos en un rebaño, pero no impiden la excreción de la bacteria [9]. Las vacunas disponibles utilizando la forma inactivada de la fase I de C. burnetii han demostrado su utilidad en varias especies de rumiantes domésticos al disminuir la excreción bacteriana en ciertas condiciones [10,11], pero las vacunas no impiden la infección.
En los últimos veinte años se han producido varios brotes de fiebre Q en todo el mundo, y varios han tenido lugar en Europa. El brote que está teniendo lugar en Holanda, que comenzó en el 2007 y que todavía está en proceso de ser controlado, ha afectado más de 2000 personas hasta ahora [12,13]. El origen más probable del brote se sitúa en la existencia de granjas de ganado caprino infectadas localizadas en la misma área, sometidas a medidas de manejo que favorecieron la diseminación de C. burnetii; el tiempo seco y el viento contribuiría a esparcir la bacteria. La magnitud que ha alcanzado este brote ha hecho necesario la introducción de importantes medidas de control en Holanda, tales como la vacunación obligatoria en pequeños rumiantes, cambios en los procedimientos de manejo (prohibición de esparcir abono de granjas afectadas, controles en el transporte animal) y recientemente el sacrificio masivo de animales procedentes de granjas infectadas. Todo ello ha hecho surgir cierto debate en los medios de comunicación sobre la efectividad de las medidas implementadas [14]. En este sentido, el Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC) ha señalado que "podría ser necesario reforzar la vigilancia sobre la fiebre Q en la UE" [15].
Las estrategias de vigilancia que pueden aplicarse para el control de la fiebre Q son variadas, ya que hay varias técnicas disponibles capaces de detectar al patógeno, si bien todas ellas presentan ciertas limitaciones. El diagnóstico clínico en el ganado es difícil, ya que la infección suele cursar de forma asintómatica, llevando a una subestimación de su prevalencia. La detección directa del patógeno puede realizarse mediante el cultivo bacteriológico del agente o la detección de su ADN. El cultivo de C. burnetii no suele ser una técnica utilizada, debido a las dificultades inherentes al manejo de un patógeno tan infeccioso, y a la necesidad de contar con instalaciones de bioseguridad de nivel 3. La otra alternativa, la amplificación del ADN bacteriano, es un método seguro, rápido y sensible para detectar el patógeno, aunque solo puede ser útil para la detección de animales infectados cuando éstos están excretando la bacteria. Otra aproximación al diagnóstico de la fiebre Q es la utilización de técnicas indirectas, basadas en la detección de anticuerpos específicos en hospedadores infectados (cuya producción empieza normalmente 2-3 semanas post-infección). Esta estrategia es adecuada para el análisis de números elevados de muestras, pero su interpretación a nivel individual es normalmente compleja. Entre las técnicas utilizadas normalmente, la técnica de inmunofluorescencia indirecta (IFA) y el ELISA presentan la mayor sensibilidad y especificidad, y ésta última puede ser fácilmente automatizada para el análisis de numerosas tandas de muestras de suero. Por otra parte, un porcentaje de animales infectados que pueden estar excretando la bacteria sin mostrar signos clínicos pueden ser seronegativos, y por tanto no ser detectados por estos tests.
En resumen, hay una falta de información sobre la situación de la fiebre Q en el mundo, ya que esta enfermedad no está sometida a programas de control en el ganado, y su incidencia en la población es difícil de valorar debido a la elevada proporción de infecciones asintomáticas en el hombre. Sin embargo, debido a su baja dosis infectiva y a su potencial patogenicidad (llegando a causar consecuencias fatales en un porcentaje importante de los casos crónicos) el problema de la fiebre Q y sus potenciales hospedadores debería ser abordado para estimar con precisión el riesgo para el gran público y prevenir futuros problemas. El brote que está teniendo lugar en la actualidad en Holanda demuestra la capacidad de C. burnetii para causar problemas muy importantes en la Salud Pública y la Sanidad Animal cuando se introducen ciertos cambios en los sistemas productivos.
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Bibliografía
1. Arricau-Bouvery, N, Rodolakis,A. Is Q fever an emerging or re-emerging zoonosis? Vet.Res. 2005; 36: 327-349.
2. Maurin, M, Raoult,D. Q fever. Clin.Microbiol.Rev. 1999; 12: 518-553.
3. Greenslade, E et al. Has Coxiella burnetii (Q fever) been introduced into New Zealand? Emerg.Infect.Dis. 2003; 9: 138-140.
4. Hilbink, F et al. Q fever is absent from New Zealand. Int.J.Epidemiol. 1993; 22: 945-949.
5. Cutler, SJ, Bouzid,M, Cutler,RR. Q fever. J.Infect. 2007; 54: 313-318.
6. Hartzell, JD et al. Q fever: epidemiology, diagnosis, and treatment. Mayo Clin.Proc. 2008; 83: 574-579.
7. Tissot-Dupont, H, Raoult,D. Q fever. Infect.Dis.Clin.North Am. 2008; 22: 505-14, ix.
8. Cetinkaya, B et al. Seroprevalence of coxiellosis in cattle, sheep and people in the east of Turkey. Vet.Rec. 29-1-2000; 146: 131-136.
9. Astobiza, I et al. Kinetics of Coxiella burnetii excretion in a commercial dairy sheep flock after treatment with oxytetracycline. Vet.J. 6-3-2009;
10. Guatteo, R et al. Prevention of Coxiella burnetii shedding in infected dairy herds using a phase I C. burnetii inactivated vaccine. Vaccine 12-8-2008; 26: 4320-4328.
11. Arricau-Bouvery, N et al. Effect of vaccination with phase I and phase II Coxiella burnetii vaccines in pregnant goats. Vaccine 15-8-2005; 23: 4392-4402.
12. Delsing, CE, Kullberg,BJ. Q fever in the Netherlands: a concise overview and implications of the largest ongoing outbreak. Neth.J.Med. 2008; 66: 365-367.
13. Schimmer, B et al. Sustained intensive transmission of Q fever in the south of the Netherlands, 2009. Euro.Surveill 2009; 14:
14. van der Lugt, H. Q-fever is killing more people than Mexican flu. NRC Handelsblad 1-9-2009;
15. European Centre for Disease Prevention and Control (ECDC). Q fever: An under-recognised disease that can cause outbreaks. Executive Science Update (Quarterly newsletter for Policymakers) 5-12-2008