Papera Equina
Identificación de portadores de Streptococcus Equi
Dr. Andrew Waller (Animal Health Trust, Reino Unido), British Horse Society Scotland, STEPS (Strategy To Eradicate and Prevent Strangles)
Streptococcus equi (S. equi) es la bacteria que causa la papera equina. Algunos caballos son portadores de S. equi, lo cual implica que están infectados con S. equi pero no muestran síntomas de la enfermedad, pudiendo actuar como reservorio e infectar caballos susceptibles. Los caballos jóvenes (potros al destete y potros de uno o dos años) son particularmente susceptibles a esta enfermedad, aunque la papera equina puede afectar a caballos de cualquier edad.
Los brotes de papera equina ocurren normalmente como consecuencia del movimiento de caballos o la introducción de portadores en una población de caballos susceptibles. Por tanto, la identificación y el tratamiento de los portadores eliminan la posibilidad de tener caballos potencialmente infecciosos y pueden reducir de manera significativa la probabilidad de un brote en una explotación.
Los portadores de S. equi presentan normalmente la bacteria en bolsas guturales, las cuales suelen estar inflamadas. Sin embargo, en algunos casos la inflamación puede no ser obvia y S. equi puede formar una película fina e invisible (biofilm).
¿Qué caballos y cuándo analizar?
Dr. Andrew Waller (Animal Health Trust, Reino Unido)
- Caballos que muestran síntomas agudos y típicos de papera equina: El diagnóstico se puede confirmar mediante cultivo bacteriológico y/o PCR cuantitativa (Real Time PCR) de S. equi en muestra de exudado nasal, contenido de absceso en linfonódulos o hisopo nasofaríngeo.
- Al final de un brote de papera equina (al menos 30 días tras la resolución de los síntomas clínicos en todos los caballos afectados), los caballos que presentaron síntomas de papera equina deberían ser investigados. El método de referencia para identificar posibles portadores de S. equi es el cultivo y la PCR cuantitativa de una muestra de lavado de bolsas guturales tomada junto con un hisopo nasofaríngeo. Una alternativa es analizar 3 hisopos nasofaríngeos tomados durante tres semanas (un hisopo por semana) mediante cultivo y PCR cuantitativa.
- Caballos que no presentan síntomas clínicos de papera equina y que deben analizarse de manera previa a su introducción en una explotación, o de manera posterior a un brote de papera equina en el que no estuvieron afectados: Estos caballos pueden analizarse serológicamente mediante ELISA, en dos muestras tomadas con una diferencia de 14 días para demostrar que no existe seroconversión. En el caso en el que la primera muestra fuera positiva, o si existiera seroconversión, debería investigarse la posibilidad de que dicho caballo sea portador de S. equi (mediante cultivo y PCR cuantitativa).
Toma de muestras
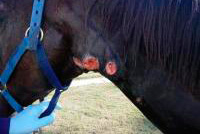
Hisopo nasofaríngeo
Método de muestreo mediante hisopo nasofaríngeo

Dr. Jamie Gartside (Tay Valley Vets, Reino Unido), British Horse Society Scotland, STEPS (Strategy To Eradicate and Prevent Strangles)
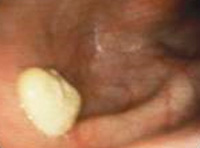
Lavado de bolsas guturales
En aquellos caballos en los que se obtiene un resultado positivo en un hisopo nasofaríngeo, o en aquellos en los que se quiere descartar el estado de portador, el examen endoscópico y lavado de bolsas guturales es esencial.
Método de muestreo mediante lavado de bolsas guturales:
- Introducir el endoscopio a través del meato nasal ventral del ollar del mismo lado que la bolsa gutural que se quiere muestrear y hasta llegar a la faringe. Las aberturas de las bolsas guturales se muestran como pliegues de la mucosa a cada lado de la faringe.
- Pasar los fórceps de biopsia o una guía similar a través del canal de biopsia y por debajo del pliegue de la bolsa gutural e introducir el endoscopio en la bolsa. Girar el endoscopio suavemente ayuda a la introducción en la bolsa.
- Una vez en la bolsa gutural, inspeccionarla y reemplazar el instrumento de guía en el canal de biopsia por un catéter estéril.
- Asegurarse de que la cabeza del caballo está elevada antes de instilar y aspirar aproximadamente 50 ml de solución salina estéril en el interior de la bolsa gutural mediante una jeringa acoplada al catéter.
- El lavado en su totalidad debería introducirse en un tubo estéril, identificado con el nombre del caballo y la localización del aspirado (bolsa gutural izquierda o derecha).
El lavado deberá enviarse al laboratorio tan pronto como sea posible (menos de 48 horas) y deberá acompañarse de su correspondiente hoja de solicitud.
Serología - S. equi ELISA
Mediante este test serológico se pueden identificar aquellos caballos que han estado en contacto con S. equi en los últimos 6 meses y que por tanto han desarrollado anticuerpos frente a la proteína M de S. equi (SeM).
- Si la primera muestra es negativa en el ELISA, se debe tomar una segunda muestra con una diferencia de 14 días; si la segunda muestra es negativa, el caballo queda descartado como portador de S. equi.
- Si la primera muestra es negativa en el ELISA y la segunda es positiva, el caballo ha tenido contacto con S. equi y por tanto se debería investigar mediante cultivo y PCR cuantitativa.
- Si la primera muestra es positiva en el ELISA, el caballo debería investigarse mediante cultivo y PCR cuantitativa.
Para más información y resolución de dudas acerca del diagnóstico, el tratamiento o el control de un brote de papera equina puede dirigirse a:
Servicio de Vigilancia Sanitaria Equina
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Tel.: (+34) 913944096
seviseq@ucm.es
Bibliografía
- Waller, A.S. 2013. Strangles: Taking steps towards eradication. Vet Microbiol. 167(1-2): 50-60.
- Newton, J.R., Wood J.L., Dunn K.A., DeBrauwere M.N., Chanter N. 1997. Naturally occurring persistent and asymptomatic infection of the guttural pouches of horses with Streptococcus equi. Vet. Rec. 140: 84–90.
- Robinson, C., Steward K.F., Potts N., Barker C., Hammond T.A., Pierce K., Gunnarsson E., Svansson V., Slater J., Newton J.R., Waller A.S. 2013. Combining two serological assays optimises sensitivity and specificity for the identification of Streptococcus equi subsp. equi exposure. Vet. J. 197(2):188-191.
- Sweeney, C.R., Timoney J.F., Newton J.R., Hines M.T. 2005. Streptococcus equi infections in horses: guidelines for treatment, control, and prevention of strangles. J. Vet. Intern. Med. 19:123–134.
- Verheyen, K., Newton J.R., Talbot N.C., de Brauwere M.N., Chanter N. 2000. Elimination of guttural pouch infection and inflammation in asymptomatic carriers of Streptococcus equi. Equine Vet. J. 32: 527–532.
- Waller, A.S., Jolley K.A. 2007. Getting a grip on strangles: recent progress towards improved diagnostics and vaccines. Vet. J. 173: 492–501.
- Webb, K., Barker C., Harrison T., Heather Z., Steward K.F., Robinson C., Newton J.R., Waller A.S. 2013. Detection of Streptococcus equi subspecies equi using a triplex qPCR assay. Vet. J. 195: 300–304.


