Piroplasmosis equina
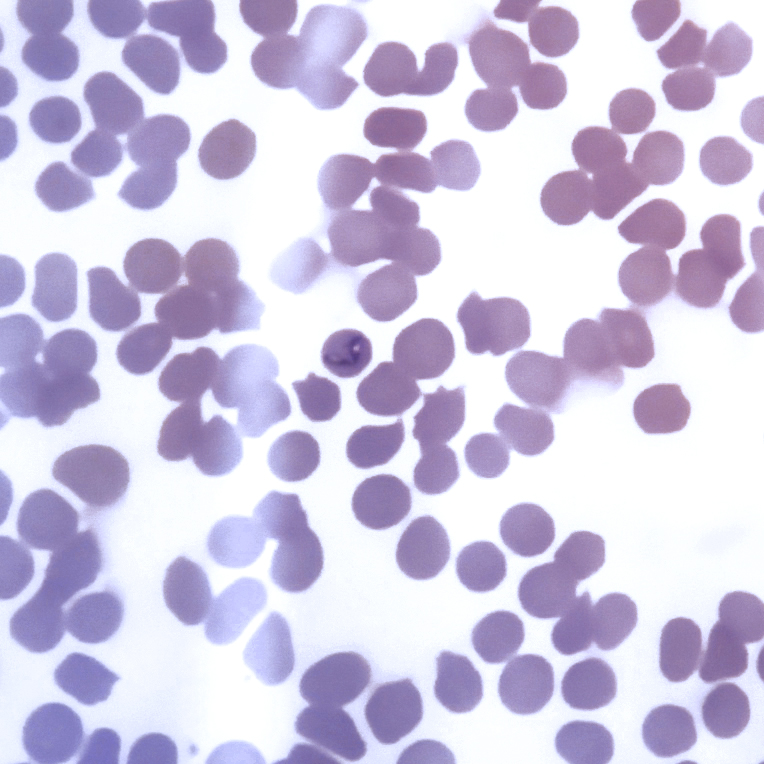
Babesia caballi (B. caballi) y Theileria equi (T.equi) son protozoos parásitos intraeritrocitarios que causan la piroplasmosis equina (PE). Anteriormente T. equi se designaba como Babesia equi. Estos parásitos son transmitidos por garrapatas del género Dermacentor, Hyalomma y Rhipicephalus, las cuales se infectan al ingerir estos protozoos que se encuentran en la sangre de los équidos infectados. Después de la recuperación, los caballos pueden convertirse en portadores de estos parásitos por mucho tiempo y actuar como fuentes de infección para las garrapatas, que a su vez parasitarán otros caballos. Además, principalmente en el caso de T. equi, puede producirse la transmisión transplacentaria de estos parásitos, naciendo potros débiles que presentan anemia e ictericia graves y mueren a las pocas horas del nacimiento o potros portadores sanos. La importancia de la piroplasmosis radica en que es la principal restricción para la exportación de equinos a otros países.
Los signos clínicos de la piroplasmosis son variables y no específicos. T. equi tiende a causar enfermedad más grave que B. caballi. En casos agudos podemos encontrar desde fiebre, inapetencia, malestar y respiración dificultosa hasta anemia, trombocitopenia, ictericia y petequias en la conjuntiva. En casos crónicos, los síntomas comunes incluyen pérdida de peso, baja tolerancia al ejercicio y ligera inapetencia. Mediante el examen rectal, normalmente el bazo se detecta aumentado de tamaño.
¿Cómo diagnosticar la piroplasmosis equina?
Durante la fase aguda de la infección, la piroplasmosis equina puede diagnosticarse mediante la identificación de los parásitos en frotis de sangre teñidos; sin embargo, este método tiene una baja sensibilidad, ya que el porcentaje de parasitemia es normalmente muy bajo, incluso en infecciones graves y especialmente en los casos de infección por B. caballi.
Existen también pruebas serológicas para el diagnóstico de esta enfermedad como son: la fijación de complemento (FC), la inmunofluorescencia indirecta (IFAT) y el enzimoinmunoensayo de competición (c-ELISA).
Con la FC se puede detectar seroconversión en los 8 a 11 días postinfección. Solo debe usarse en casos agudos ya que posee una baja sensibilidad en fases crónicas o inaparentes de la infección. Además pueden darse reacciones cruzadas entre anticuerpos contra T. equi y B. caballi.
La IFAT también está recomendada solo en procesos agudos, aunque presenta mayor sensibilidad que la anterior y los títulos de anticuerpos permanecen elevados durante más tiempo que en la FC. Es capaz de detectar seroconversión en los 3 a 20 días postinfección y se utiliza como método de apoyo a FC y a c-ELISA.
c-ELISA es considerado el método más sensible en caso de infección crónica o inaparente, detectando seroconversión 21 días después de la infección. Por lo que representa el método de elección en el caso de detección de animales portadores.
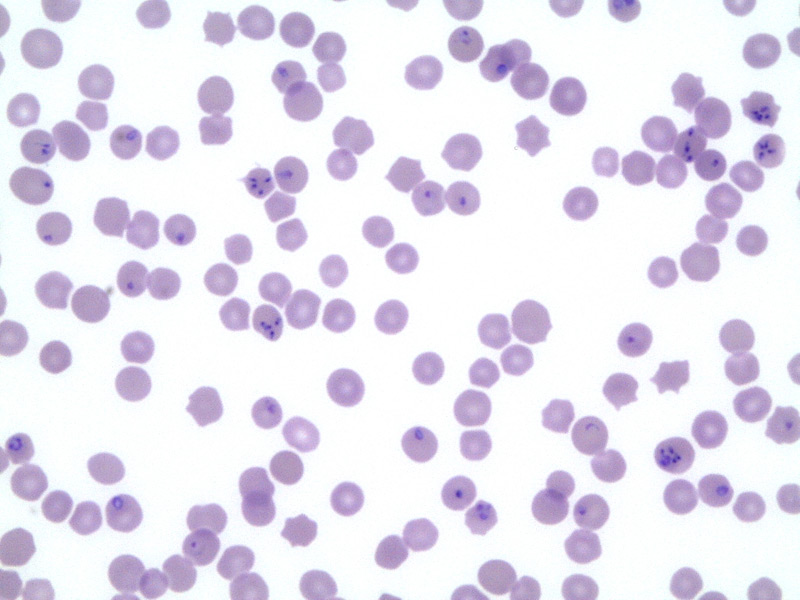
Por otro lado, la PCR, utilizada para la identificación del parásito en sangre periférica de caballos infectados, es el método con mayor sensibilidad. Aunque se ha demostrado que después del tratamiento el animal puede ser negativo a PCR pero positivo a c-ELISA hasta 24 meses después de la eliminación del parásito.
En resumen, para el diagnóstico de un caballo con síntomas clínicos compatibles con piroplasmosis equina (enfermedad aguda), el protocolo de diagnóstico sería:
- Realización de hemograma y observación de frotis sanguíneo al microscopio.
- Realización de PCR (a tiempo real) para Theileria equi y Babesia caballi.
- Realización de serología pareada (una muestra en el momento de los síntomas clínicos y una muestra a los 14-21 días) mediante FC o IFAT.
Por último, para el diagnóstico de un caballo portador, sin síntomas clínicos, o para análisis pre-compra previa exportación, la técnica ideal para el diagnóstico de piroplasmosis equina sería el c-ELISA.
Tratamiento y control de la enfermedad
Las infecciones por T. equi son más difíciles de tratar que las producidas por B. caballi. T. equi puede permanecer en el individuo infectado hasta 24 meses después del tratamiento, frente a los 3 a 15 meses en el caso de B. caballi.
Se han probado varios fármacos para el alivio de los síntomas clínicos, siendo el imidocarb dipropionato (ID) administrado IM, acompañado de una correcta hidratación del animal, el que presenta una mayor eficacia. ID, debido a su actividad anticolinesterasa, puede dar lugar a efectos adversos tales como agitación, sudoración, cólico y diarrea.
Otros fármacos utilizados en el tratamiento de la PE son el diminazeno aceturato y el diminazeno diaceturato, cuya administración puede dar lugar a daño muscular severo; la oxitetraciclina IV, la cual es efectiva frente a T. equi pero no frente a B. caballi y la buparvaquona, cuyo uso no está muy extendido.
En lo relativo al control, no existen vacunas disponibles para ninguno de estos parásitos. Los desinfectantes y la higiene no son efectivos contra la propagación de las infecciones transmitidas por garrapatas. Sin embargo, es fundamental eliminar el contacto con garrapatas mediante el uso de acaricidas. La evaluación frecuente del animal y la eliminación de cualquier garrapata también pueden ayudar a prevenir la infección.
Para más información y resolución de dudas acerca del diagnóstico, el tratamiento o el control de un brote de Piroplasmosis equina puede dirigirse a:
Servicio de Vigilancia Sanitaria Equina
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Tel.: (+34) 913944096
seviseq@ucm.es
Bibliografía
- Anon. 2010. Piroplasmosis equina. The Center for Food Security and Public Health and Institute for International Cooperation in Animal Biologics, Iowa State University.. 167(1-2): 50-60.
- Bruning A. 1996. Equine piroplasmosis an update on diagnosis, treatment and prevention. Br Vet J. 152(2):139-51.
- Dewaal DT. 1992. Equine Piroplasmosis: a Review. Brit Vet J. 148(1):6-14.
- Maurer FD. 1962. Equine Piroplasmosis-Another Emerging Disease. J Am Vet Med Assoc. 141(6):699.
- Wise LN, Kappmeyer LS, Mealey RH, Knowles DP. 2013. Review of equine piroplasmosis. J Vet Intern Med. 27(6):1334-46.
- Wise LN, Pelzel-McCluskey AM, Mealey RH, Knowles DP. 2014. Equine piroplasmosis. Vet Clin North Am Equine Pract. 30(3):677-93.
- 2013. Equine piroplasmosis. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Chapter 2.5.8.
- Kappmeyer LS, Thiagarajan M, Herndon DR, Ramsay JD, Caler E, Djikeng A, et al. 2012. Comparative genomic analysis and phylogenetic position of Theileria equi. BMC Genomics. 13:603.
- Zobba R, Ardu M, Niccolini S, Chessa B, Manna L, Cocco R, et al. 2008. Clinical and laboratory findings in equine piroplasmosis. J Equine Vet Sci. 28(5):301-8.
- Ueti MW, Mealey RH, Kappmeyer LS, White SN, Kumpula-McWhirter N, Pelzel AM, et al.. 2012. Re-Emergence of the Apicomplexan Theileria equi in the United States: Elimination of Persistent Infection and Transmission Risk. Plos One. 7(9).
- Rashid HB, Chaudhry M, Rashid H, Pervez K, Khan MA, Mahmood AK. 2008. Comparative efficacy of diminazene diaceturate and diminazene aceturate for the treatment of babesiosis in horses. Trop Anim Health Prod. 40(6):463-7.
- Schwint ON, Ueti MW, Palmer GH, Kappmeyer LS, Hines MT, Cordes RT, et al. 2009. Imidocarb Dipropionate Clears Persistent Babesia caballi Infection with Elimination of Transmission Potential. Antimicrob Agents Ch. 53(10):4327-32.



