Anaplasmosis granulocítica equina
Etiología
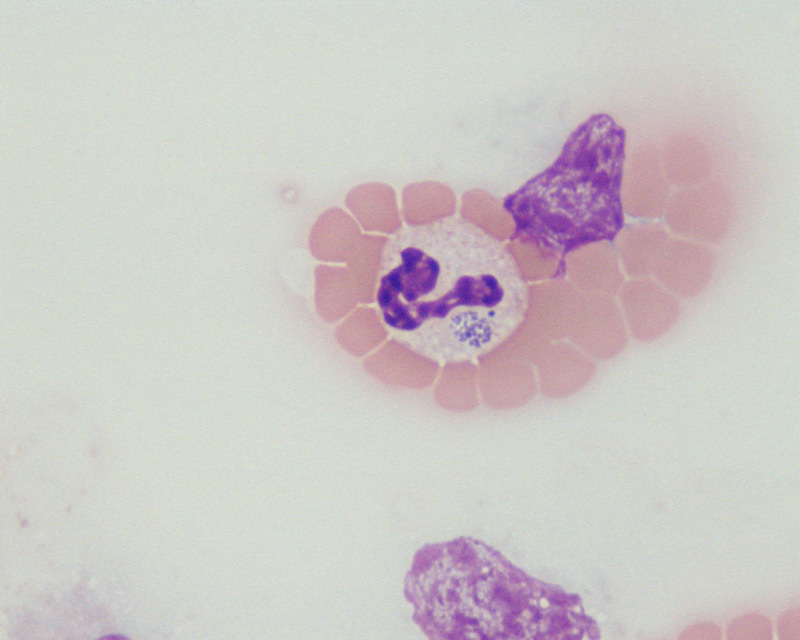
E agente etiológico, antes denominado Ehrlichia equi, se considera en la actualidad una cepa de Anaplasma phagocytophilum debido a su homología del 99.1% en la secuencia 16S de su ANR ribosómico. Cocobacilo, gram negativo, con tropismo por granulocitos, suele agregarse en vacuolas intracitoplasmáticas de 1.5 a 5 µm de diámetro, formando mórulas.
Epidemiología
Presente en Estados Unidos, Canadá, Brasil, Europa, África y Asia, la enfermedad suele darse a finales de otoño, invierno y primavera. A. phagocytophilum causa enfermedad clínica en rumiantes domésticos, équidos, perros, gatos y humanos y es transmitida por garrapatas del género Ixodes. En Europa sus reservorios son roedores silvestres, ovejas y corzos. Las aves migratorias intervienen en la dispersión de A. phagocytophilum a través de la diseminación de las garrapatas infectadas. Los équidos se consideran un hospedador aberrante, ya que la presencia de la bacteria suele limitarse a la enfermedad aguda. La enfermedad suele ser subclínica en áreas endémicas que muestran una mayor seroprevalencia y puede darse de manera concomitante con otras enfermedades como borreliosis y piroplasmosis.
Patogenia
Una vez inoculada en la dermis por la garrapata, A. phagotytophilum se disemina a través de la vía linfática o sanguínea e invade las células de los sistemas linforeticular y hematopoyético, donde se replica en el interior de vacuolas. Se tiene poco conocimiento sobre los mecanismos patogénicos exactos por los cuales la bacteria provoca una respuesta inflamatoria tanto local como sistémica en diferentes órganos, además de pancitopenia. Esto produce una disminución de las defensas del hospedador, aumentando la predisposición a desarrollar infecciones oportunistas secundarias. Entre los 19 y 81 días postinfección, se desarrolla una respuesta inmunitaria celular y humoral, con la presencia de anticuerpos que se mantendrán al menos 2 años.
Signos clínicos
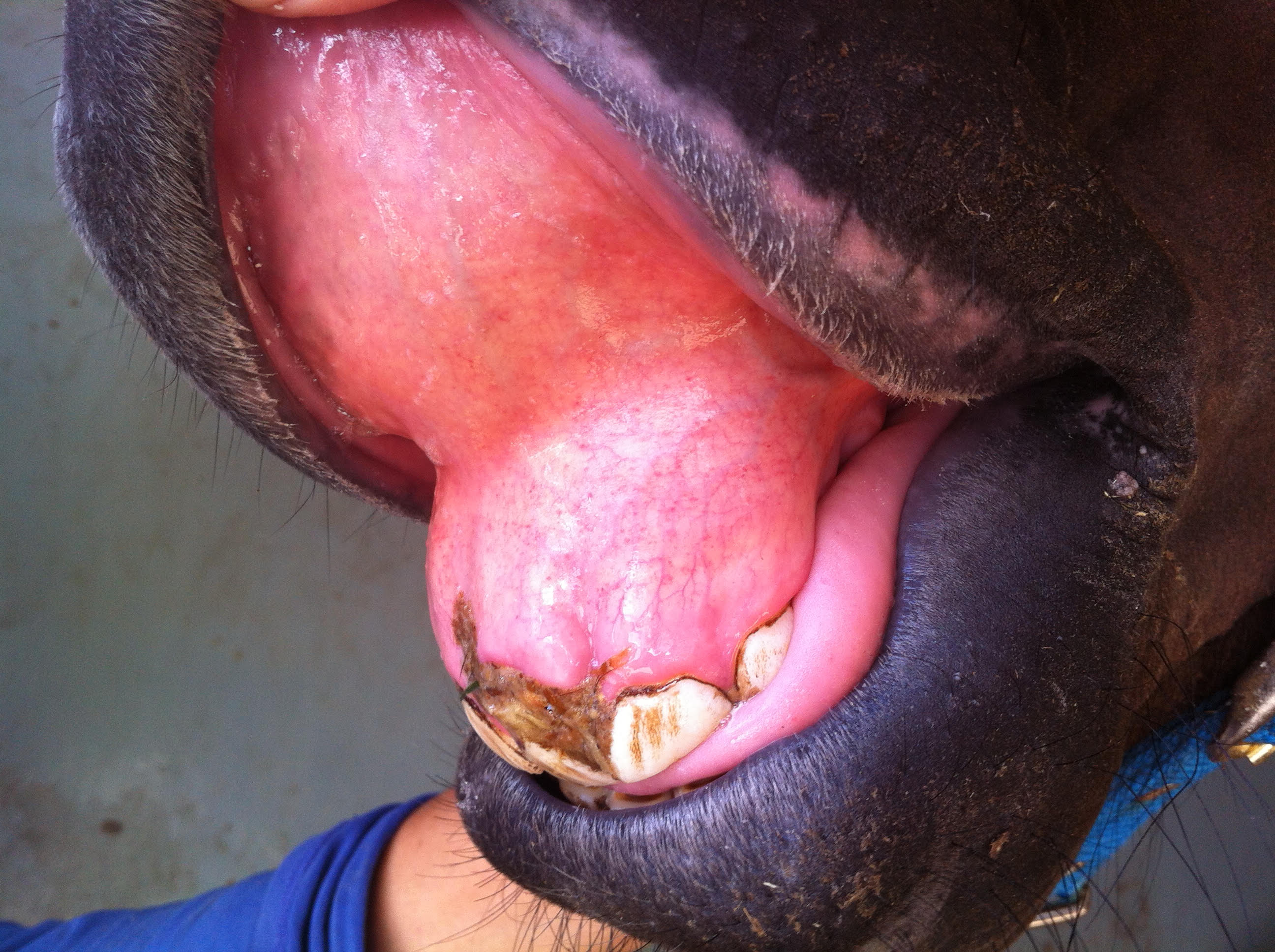
El periodo de incubación es inferior a 14 días. Los signos clínicos varían según la edad, siendo menos severos en caballos menores de 4 años. La duración de la enfermedad clínica es de 3 a 16 días y suele ser autolimitante en animales no tratados. Durante los primeros días hay fiebre alta (39.4-41.3ºC) que se mantiene hasta 14 días. Los signos iniciales son rechazo al movimiento, ataxia, depresión, anorexia parcial, ictericia y petequias (figura 2). A los 3-5 días puede presentarse edema de extremidades, infecciones secundarias, traumatismos secundarios a la incoordinación y raramente arritmias cardiacas. Las alteraciones laboratoriales observadas son la leucopenia, trombocitopenia, anemia, ictericia y la detección en frotis sanguíneo de cuerpos de inclusión o mórulas en neutrófilos y eosinófilos.
Diagnóstico
Los diagnósticos diferenciales de AGE incluyen púrpura hemorrágica, enfermedad hepática, anemia infecciosa equina, arteritis viral equina y encefalitis. El diagnóstico definitivo puede realizarse teniendo en cuenta el área geográfica, signos clínicos, hallazgos laboratoriales y la observación de más de tres mórulas en frotis sanguíneo con tinción Giemsa o Wright. Las pruebas serológicas se realizan mediante inmunofluorescencia indirecta. Existen varias PCR disponibles para la detección de los miembros del genogrupo de A. phagotytophilum, con alta sensibilidad y especificidad, interesantes durante los estadíos inicial y final de la enfermedad. Las lesiones macroscópicas observadas son edema en abdomen ventral y extremidades y hemorragias (petequias y equimosis) en extremidad distal. Los hallazgos histológicos son inflamación vascular en extremidades, órganos reproductores, plexo pampiriforme, riñones, corazón, cerebro y pulmones.
Tratamiento
La oxitetraciclina a dosis de 7 mg/kg/24h durante 5-7 días ha demostrado ser efectiva frente a AGE, con una mejora rápida de la clínica. Si no se trata, suele ser autolimitante, con 2-3 semanas de duración. En casos severos se recomienda tratamiento de soporte mediante fluidoterapia, vendaje de extremidades y confinamiento en el box. El pronóstico es excelente en casos no complicados.
Prevención y control
No existe vacuna en la actualidad. La prevención se limita a las medidas de control de garrapatas mediante el uso de productos repelentes a base de permetrinas.
Consideraciones Salud Pública
A. phagotytophilum engloba múltiples cepas, algunas de las cuales tienen potencial zoonótico. Estudios filogenéticos indican que cepas aisladas de humanos, perros y caballos en Europa, pertenecen al mismo complejo clonal. También se sospecha que el jabalí y el erizo son reservorios de las variantes humanas. Aun así, existen pocos casos diagnosticados de Anaplasmosis granulocítica humana, principalmente por la inespecificidad de los signos clínicos.
Referencias
- Pusterla, N. and J. E. Madigan (2013). "Equine Granulocytic Anaplasmosis." Journal of Equine Veterinary Science 33(7):493-496.
- Stuen, S. (2007). "Anaplasma phagocytophilum-the most widespread tick-borne infection in animals in Europe." Vet Res Commun 31(1):79-84.
- Stuen, S., et al. (2014). "Anaplasma phagocytophilum-pathogen with a zoonotic potential." Parasites & vectors 7(1):O24.