Fiebre equina de Potomac
Etiología
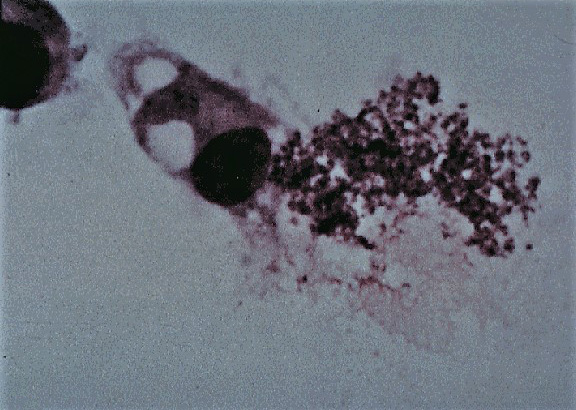
La Fiebre equina del Potomac es una enfermedad infecciosa equina causada por Neorickettsia (anteriormente Ehrlichia) risticii, bacteria Gram-negativa intracelular obligada de la Familia Anaplasmataceae (Orden Rickettsiales, Género Neorickettsia) descrita en 1984 en los Estados Unidos.
Epidemiología
Los únicos estudios en los que se ha determinado la prevalencia de N. risticii se han realizado en EEUU, donde es endémica. En 1996, Atwill y colaboradores, obtuvieron un 7% de prevalencia en caballos no vacunados en el estado de Nueva York. En California, Pusterla y colaboradores (2000), hallaron una seroprevalencia del 15%. Otros estudios realizados en Ohio, Minnesota e Illinois reportaron seroprevalencias del 13%, 24% y 26%, respectivamente. Se han descrito también casos aislados en Canadá, América del Sur y Europa. La bacteria ha sido aislada también en gato, perro, cabra, cerdo y ratón, aunque en estas especies, la enfermedad cursa de forma subclínica. La fiebre del Potomac tiene carácter estacional, manifestándose principalmente en primavera, verano y principios de otoño, coincidiendo con la mayor proliferación de los potenciales vectores.
Patogenia
El ciclo biológico de la bacteria causante de la fiebre de Potomac no se conoce completamente, aunque parece que el vector principal es un trematodo infectado con N. risticii. El trematodo infecta caracoles acuáticos y acaba volviendo al agua donde es ingerido a su vez por los estadios larvarios de numerosos insectos acuáticos como las de los Órdenes Trichoptera, Ephemeroptera, Odonata y Zygoptera. Se cree que la infección de los caballos de debe en la ingestión accidental de insectos adultos que albergan N. risticii en la fase metacercaria de un trematodo y que vuelan dentro de las cuadras o en los pastos o puntos de agua. La bacteria origina una enterocolitis aguda en los caballos, en los que suele localizarse en el interior de los monocitos de la sangre o macrófagos del tejido linfoide. No se ha demostrado la transmisión por contacto directo ni por otros vectores como garrapatas o pulgas, como ocurre en otras especies de la familia Anaplasmatacea. La transmisión transplacentaria se ha demostrado experimentalmente. El estudio se realizó en un grupo de yeguas gestantes, produciéndose abortos en un alto porcentaje de ellas. El aborto es tardío (a partir de los 100 días post-infección). Los potros nacidos de las yeguas infectadas poseen anticuerpos frente a N. risticii.
Signos clínicos
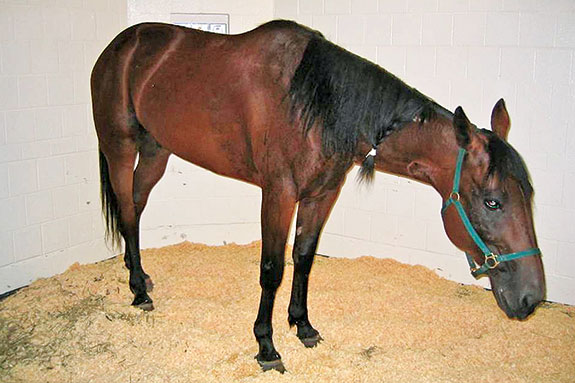
La infección se caracteriza por la aparición de ligera depresión y anorexia seguida de fiebre (38.9-41.7 °C). En esta fase, los borborigmos intestinales pueden estar reducidos. Transcurridas 24-48 h puede aparecer una diarrea moderada o severa en el 60% de los caballos infectados que suele ir acompañada de dolor abdominal moderado. Algunos caballos pueden desarrollar signos severos de infección o deshidratación. Los signos pueden ser indistinguibles de aquellos originados por otras bacterias causantes de enterocolitis. En un 20-30% de los caballos puede producirse laminitis. Los hallazgos hematológicos son variables, pudiendo ser normal en las fases iniciales o aparecer leucopenia (neutropenia y linfopenia) y trombocitopenia. La leuocitosis es frecuente una vez avanzada la infección. En la necropsia, los caballos presentan enterocolitis e inflamación difusa principalmente del intestino grueso. La mortalidad puede oscilar entre el 5 y el 30%.
La infección del feto en hembras gestantes puede desencadenar aborto, el cual puede ir acompañado de placentitis y retención placentaria. Los fetos abortados pueden presentar colitis, hepatitis periportal e hiperplasia linfoide en los linfonodos mesentéricos y el bazo.
Diagnóstico
El diagnóstico basado en la presencia de signos clínicos y aspectos epidemiológicos como la estacionalidad y localización geográfica no es definitivo. Para confirmar la infección es necesario hacer aislamiento o detección de N. risticii en sangre o heces de los caballos mediante cultivo o PCR. El cultivo no suele hacerse de rutina debido a su dificultad y lentitud. Existen técnicas de PCR en tiempo real que permiten la detección del ADN de la bacteria en menos de 2 h en muestras de sangre y heces (idealmente ha de realizarse en las dos simultáneamente para incrementar la sensibilidad) y suele ser la opción más empleada.
El valor diagnóstico de la serología es limitado, aunque algunos caballos pueden tener títulos elevados en el momento de la infección. De hecho, suelen ser frecuentes los falsos positivos en las pruebas serológicas, lo que dificulta el diagnóstico con técnicas indirectas.
Tratamiento
Los caballos infectados en fases recientes pueden ser tratados con éxito empleando oxitetraciclina (6.6 mg/kg IV). La respuesta al tratamiento suele observarse normalmente transcurridas 12 h mediante una disminución de la temperatura rectal seguida de una mejora del resto de los signos clínicos asociados. Si la terapia se inicia pronto, los signos pueden desaparecer al tercer día del tratamiento y no suele ser necesario alargar el tratamiento más allá de 5 días. En animales que presentan enterocolitis, es necesario administrar tratamientos de fluidoterapia. La laminitis, en el caso de aparecer, es severa suele ser refractaria al tratamiento.
Prevención y control
Actualmente existen varias vacunas inactivadas comerciales. Estudios realizados en animales infectados experimentalmente sugieren una eficacia vacunal en torno al 78% aunque en condiciones de campo podría ser menor. Los fallos vacunales se atribuyen principalmente a que el papel de los anticuerpos en la protección es limitado. Las medidas de prevención más importantes pueden ser evitar zonas endémicas, la higienización del agua y los bebederos y la instauración de medidas para evitar la presencia de insectos en los establos.
Consideraciones Salud Pública
La Fiebre equina del Potomac no es una zoonosis.
Referencias
- Atwill ER, Mohammed HO. J Am Vet Med Assoc. 1996 Apr 15;208(8):1295-9. Benefit-cost analysis of vaccination of horses as a strategy to control equine monocytic ehrlichiosis.
- Bertin FR, Reising A, Slovis NM, Constable PD, Taylor SD. Clinical and clinicopathological factors associated with survival in 44 horses with equine neorickettsiosis (Potomac horse Fever). J Vet Intern Med. 2013 Nov-Dec;27(6):1528-34. doi: 10.1111/jvim.12209. Epub 2013
- Heller MC, McClure J, Pusterla N, Pusterla JB, Stahel S. Two cases of Neorickettsia (Ehrlichia) risticii infection in horses from Nova Scotia. Can Vet J. 2004 May;45(5):421-3. PubMed PMID: 15206592; PubMed Central PMCID: PMC548627.
- Potomac horse fever. AAEP Infectious Disease Guidelines.
- Potomac horse fever. Digestive System, MSD Veterinary Manual.
- 6: Pusterla N, Johnson E, Chae J, Pusterla JB, DeRock E, Madigan JE. Infection rate of Ehrlichia risticii, the agent of Potomac horse fever, in freshwater stream snails (Juga yrekaensis) from northern California. Vet Parasitol. 2000 Sep 20;92(2):151-6. PubMed PMID: 10946138.
- Ristic M, Holland CJ, Dawson JE, Sessions J, Palmer J. Diagnosis of equine monocytic ehrlichiosis (Potomac horse fever) by indirect immunofluorescence. J Am Vet Med Assoc. 1986 Jul 1;189(1):39-46. PubMed PMID: 3525479.
- Xiong Q, Bekebrede H, Sharma P, Arroyo LG, Baird JD, Rikihisa Y. An Ecotype of Neorickettsia risticii Causing Potomac Horse Fever in Canada. Appl Environ Microbiol. 2016 Sep 16;82(19):6030-6. doi: 10.1128/AEM.01366-16. Print 2016 Oct. PubMed PMID: 27474720; PubMed Central PMCID: PMC5038023.