AIE: Anemia Infecciosa Equina
La anemia infecciosa equina (AIE) o fiebre de los pantanos es una enfermedad infecciosa crónica exclusiva de los équidos, producida por un lentivirus de la familia Retroviridae. Este virus se transmite de forma mecánica por insectos picadores hematófagos, los cuales actúan como vectores. Las moscas de los establos (Stomoxys calcitrans) son capaces de transmitir esta infección; sin embargo, los vectores más efectivos son las moscas picadoras de la familia Tabanidae. También puede producirse una transmisión in utero de la yegua al feto y a través de la leche en algunos potrillos lactantes. El riesgo de transmisión vertical es más probable si la yegua presenta signos clínicos antes del parto. Por último, existe también la posibilidad de transmisión iatrogénica, mediante el uso de agujas o material contaminado y transfusiones de sangre.
Después de la infección la mayoría de los caballos se convierten en portadores asintomáticos del virus, el cual permanece latente hasta que se producen otras enfermedades simultáneas, estrés severo o trabajo intenso, dando lugar a episodios transitorios de fiebre, anemia, pérdida de peso y depresión. También existe una forma aguda que se caracteriza por signos clínicos inespecíficos como fiebre, ictericia, edema ventral, diarrea hemorrágica y petequias en la mucosa. En los caballos, el virus queda acantonado en los leucocitos sanguíneos, pero también puede estar presente en el plasma durante los episodios de pirexia.
Situación en España
España es un país libre de AIE desde el año 1983, cuando el último brote de AIE fue declarado resuelto. Desde este año solo se poseen datos de seroprevalencia de AIE en la zona centro de España en un estudio realizado por Cruz y colaboradores, en el cual se analizaron 555 caballos pura raza española (P.R.E.) sin detectar ningún caso seropositivo.
¿Cómo diagnosticar la anemia infecciosa equina?
El diagnóstico se realiza principalmente mediante dos técnicas serológicas: ensayo por inmunoabsorción ligado a enzimas (ELISA) y prueba de inmunodifusión en gel de agar (AGID o test de Coggins).
TEST DE COGGINS
Según la OIE, el test de Coggins es el test oficial de referencia para el diagnóstico de la AIE. Es capaz de detectar anticuerpos a partir de las 2-3 semanas postinfección, aunque se han descrito casos de caballos seronegativos hasta los 60 días post-infección. Los resultados son obtenidos a las 48 horas y se requiere experiencia en su interpretación.
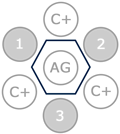
El test de Coggins es una técnica de inmunoprecipitación, en la que se enfrenta el antígeno del virus de la AIE a los anticuerpos presentes en el suero del caballo, y a los anticuerpos presentes en un suero control positivo.
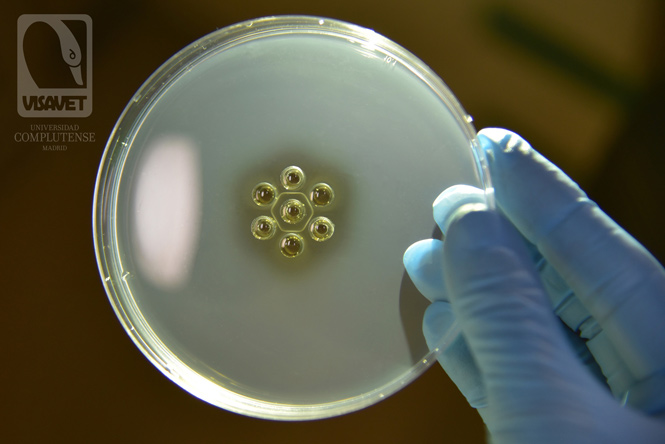
AGID o test de Coggins positivo
En un test de Coggins positivo, se produce una inmunoprecipitación por la unión entre el antígeno (pocillo central) y los anticuerpos presentes en los controles positivos (C+) y en las muestras (1, 2 y 3). En la imagen las tres muestras (1, 2 y 3) son positivas a AIE por lo que se observa una línea en todos los pocillos, dando una imagen hexagonal.
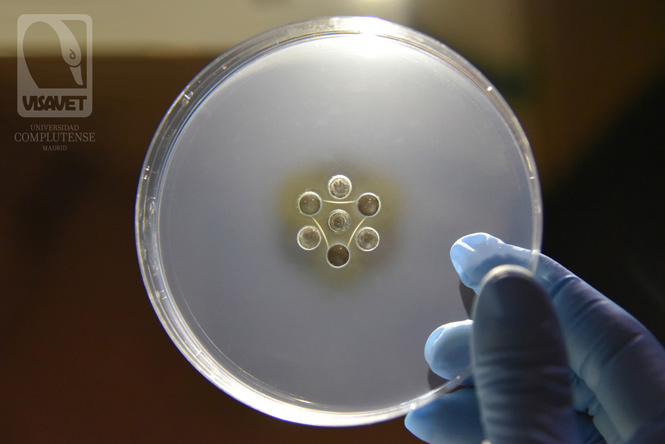
AGID o test de Coggins negativo
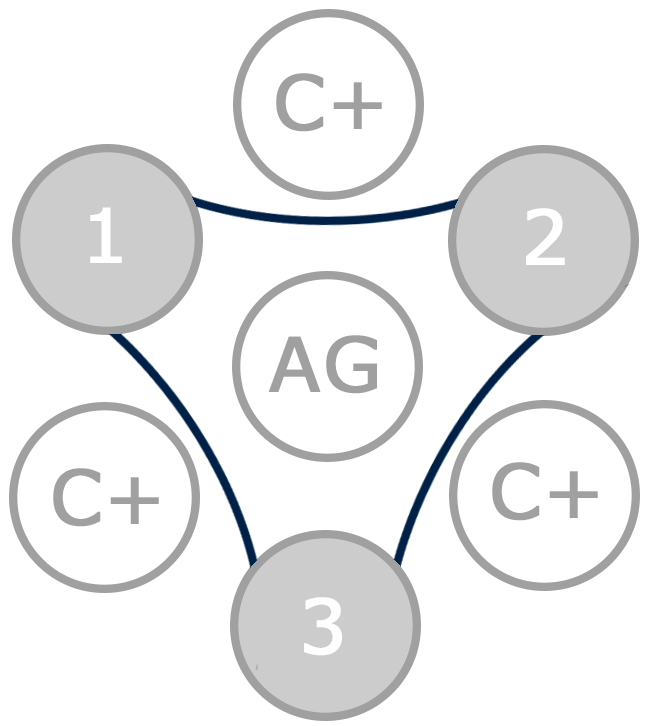
En un test de Coggins negativo, se produce una inmunoprecipitación por la unión entre el antígeno (pocillo central) y los anticuerpos presentes en los controles positivos (C+), pero la inmunoprecipitación no ocurre en el caso de las muestras (1, 2 y 3). En la imagen las tres muestras (1, 2 y 3) son negativas a AIE por lo que se observa una línea tan sólo en los controles positivos, dando una imagen triangular.
TEST DE ELISA
Este test proporciona resultados en menos tiempo y con una mayor sensibilidad y objetividad que el anterior. Se trata de una técnica más sensible que el test de Coggins pero es frecuente la aparición de falsos positivos debido a su menor especificidad. Es por ello que se recomienda la confirmación de los casos positivos a ELISA mediante el test de Coggins.
RT-PCR
Por último, para la detección del del virus de la AIE en sangre periférica de caballos se ha descrito la RT-PCR. Esta técnica se utiliza principalmente ante casos de:
- Confirmación de casos sospechosos por serología.
- Resultados contradictorios entre la técnicas serológicas.
- Determinación del estatus sanitario de potros nacidos de yeguas infectadas.
Tratamiento y control de la anemia infecciosa equina
La AIE es una enfermedad de declaración obligatoria ante la Organización Mundial de Sanidad Animal (OIE) y la Unión Europea. En España, tal y como se especifica en la ley 8/2003 de Sanidad Animal, ante una sospecha de AIE, el veterinario debe comunicar la situación a los Servicios Oficiales de su Comunidad Autónoma, los cuales tomarán muestras oficiales para la confirmación en el Laboratorio Nacional de Referencia. En los casos de muestras seropositivas a AIE detectadas en laboratorios privados en análisis informativos de caballos sin sintomatología (ej. previos a exportación), tanto los laboratorios como el veterinario responsable de las muestras están obligados a notificar los casos seropositivos a la Autoridad Sanitaria competente.
En muchos países, incluido España, el sacrificio de los animales positivos a AIE es obligatorio. Estos animales deben ser aislados del resto y sometidos a un tratamiento paliativo hasta que se ordene su sacrificio. En caso de brote, se debe confinar a los caballos en grupos pequeños y controlar el movimiento de equinos. Además, la fumigación y el uso de repelentes de insectos pueden ayudar a la interrupción de la infección.
No existe vacuna disponible frente a la AIE debido a la alta capacidad de mutación del virus, por lo que la estrategia de control se basa en la cuarentena, además de la realización de encuestas epidemiológicas para determinar la existencia de posibles portadores entre los caballos en contacto con los casos positivos.
Envío de muestras para análisis informativos
El Servicio de Vigilancia Sanitaria Equina (SEVISEQ) del centro VISAVET es un laboratorio autorizado para el análisis de AIE mediante ELISA y test de Coggins en muestras tomadas para análisis informativos (previos a exportación o movimientos y procedentes de caballos sin sospecha ni síntomas clínicos).
Para la realización de estos análisis, es necesario que las muestras de suero vengan acompañadas del microchip o UELN del caballo, así como del código REGA de la explotación a la que pertenecen.
Para más información y resolución de dudas acerca de la AIE puede dirigirse a:
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Tel.: (+34) 913944096
seviseq@ucm.es
Bibliografía
- Anon. 2009. Equine Infectious Anemia. The Center for Food Security and Public Health and Institute for International Cooperation in Animal Biologics, Iowa State University..
- Equine infectious anemia. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. 2013. Chapter 2.5.6.
- Pearson, J. E. and Knowles, R.C. 1984. Standardization of the equine infectious anemia immunodiffusion test and its application to the control of the disease in the United States. Journal of the American Veterinary Medicine Association. 184(3):298-301.
- Coggins, L., Norcross, N.L. and Nusbaum, S.R. 1972. Diagnosis of equine infectious anemia by immunodiffusion test. American Journal of Veterinary Reseach. 33(1):11-18.
- Cook, R. F., Cook, S.J., Li, F.L., Montelaro, R.C. and Issel, C.J. 2002. Development of a multiplex real-time reverse transcriptase-polymerase chain reaction for equine infectious anemia virus (EIAV). Journal of Virological Methods. 105(1):171-179.
- Cruz F., Fores P., Ireland J., Moreno MA. and Newton R. 2015. Freedom from equine infectious anaemia virus infection in Spanish Purebred horses. Veterinary Record Open. 2:e000074.2015.
- Issel, C. J. and Cook, R.F. 1993. A review of techniques for the serologic diagnosis of equine infectious anemia. Journal of Veterinary Diagnostic Investigation. Journal of Virological Methods. 5(1):137-141.
- Issel, C. J., Rushlow, K., Foil, L.D. and Montelaro, R.D. 1998. A perspective on equine infectious anemia with an emphasis on vector transmission and genetic analysis. Vet Microbiol. 17(3):251-286.
- Issel, C. J., Scicluna, M.T., Cook, S.J., Cook, R.F., Caprioli, A., Ricci, I., Rosone, F., Craigo, J.K., Montelaro, R.C. and Autorino, G.L. 2013. Challenges and proposed solutions for more accurate serological diagnosis of equine infectious anaemia. The Veterinary Record. 172(8):210.
- More, S. J., Aznar, I., Bailey, D.C., Larkin, J.F., Leadon, D.P., Lenihan, P., Flaherty, B., Fogarty, U. and Brangan, P. 2008. An outbreak of equine infectious anaemia in Ireland during 2006: investigation methodology, initial source of infection, diagnosis and clinical presentation, modes of transmission and spread in the Meath cluster. Equine Veterinary Journal. 40(7):706-708.
- Nagarajan, M.M. and Simard, C. 2001. Detection of horses infected naturally with equine infectious anemia virus by nested polymerase chain reaction. Journal of Virological Methods. 94(1-2):97-109.
- Sellon, D.C. 1993. Equine infectious anemia. Veterinary Clinics of North America Equine Practice. 9(2):321-336.
- Singha, H., Goyal, S.K., Malik, P., Khurana, S.K. and Singh, R.K. 2013. Development, evaluation, and laboratory validation of immunoassays for the diagnosis of equine infectious anemia (EIA) using recombinant protein produced from a synthetic p26 gene of EIA virus. Indian Journal of Virology. 24(3):349-356
- Soutullo, A., Verwimp, V., Riveros, M., Pauli, R. and Tonarelli, G. 2001. Design and validation of an ELISA for equine infectious anemia (EIA) diagnosis using synthetic peptides. Veterinary Microbiology. 79(2):111-121.