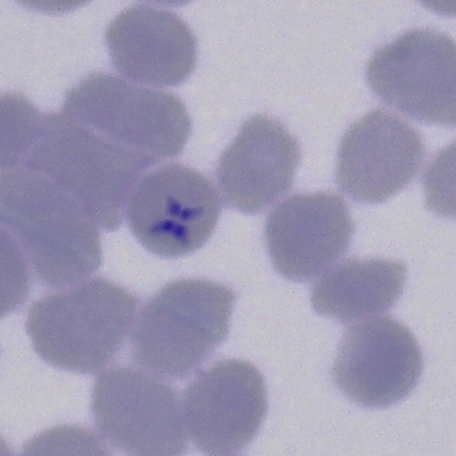
Cultivo in vitro de Theileria equi y Babesia caballi
La piroplasmosis equina (PE) es una enfermedad infecciosa de los équidos producida por los protozoos parásitos intraeritrocitarios Babesia caballi (B. caballi) y Theileria equi (T. equi). La importancia de esta enfermedad radica en que, tras la infección, los caballos pueden permanecer como portadores crónicos de estos parásitos durante largos periodos de tiempo siendo seropositivos pero mostrando sólo signos clínicos en casos de inmunosupresión o de ejercicio intenso. La PE implica graves pérdidas económicas para el sector equino ya que se trata de la enfermedad que supone una mayor restricción en la exportación de caballos a países libres de la misma.
Para el diagnóstico de la PE se pueden utilizar tanto métodos directos (visualización de los parásitos en frotis de sangre, PCR y cultivo in vitro) como métodos serológicos o indirectos (cELISA, fijación de complemento e inmunofluorescencia indirecta).
El cultivo de estos parásitos in vitro es una técnica ya descrita en el año 1987. Los primeros datos sobre el cultivo específico de B. caballi y de T. equi se remontan a los años 1993 y 1994, respectivamente. Desde entonces y hasta el año 2002 han sido publicados varios estudios con el fin de conseguir una mejora de esta técnica y poder identificar caballos portadores.
En nuestro laboratorio dicha técnica ha sido implementada recientemente tras una colaboración con el laboratorio de diagnóstico de la USDA-APHIS en Iowa, Estados Unidos, consiguiendo aislados de cepas de campo de ambos parásitos. Actualmente esta técnica se realiza en muy pocos laboratorios, ya que se necesitan condiciones muy específicas para el crecimiento de los parásitos.
Para la realización de cultivos in vitro de T. equi y de B. caballi es necesario disponer de una sala limpia destinada exclusivamente para tal fin. La sangre de caballos sospechosos utilizada para la iniciación de los cultivos debe ser recogida en tubos con EDTA como anticoagulante. Una vez en el laboratorio, los eritrocitos en la sangre se lavan varias veces mediante centrifugación y posterior resuspensión del pellet con PBS estéril. Después de cada lavado el plasma sanguíneo y las células blancas deben ser retiradas.

Los eritrocitos lavados son incubados en distintas placas de cultivo celular con un medio específico para T. equi y otro para B. caballi. La fabricación de los medios específicos se realiza en una cabina de seguridad biológica de clase II y se utilizan aminoácidos, enzimas, antibióticos/antimicóticos y un tampón estabilizador del pH; entre otros componentes. Ambas placas se introducen en distintas cámaras incubadoras, las cuales se llenan con una mezcla de gases compuesta por distintas concentraciones de O2, CO2 y N, simulando los gases sanguíneos. Dicha mezcla de gases se deja fluir durante 1 min para conseguir el completo llenado de la cámara.

Por último, ambas cámaras incubadoras son guardadas en una estufa húmeda de CO2 con el fin de conseguir una atmósfera controlada. Una vez inicializados los cultivos, se debe cambiar el medio específico diariamente y hacer un seguimiento del crecimiento y la multiplicación de los parásitos mediante la visualización de éstos en un frotis sanguíneo una vez a la semana. El tiempo de crecimiento de los parásitos dependerá del porcentaje de parasitemia existente inicialmente, pudiendo variar desde dos semanas hasta un mes.

Aunque el principal objetivo que se pretende conseguir con la realización del cultivo in vitro es su uso como método adicional para la identificación de caballos portadores de PE, también se trata de una técnica destinada a otros fines como pueden ser la evaluación del efecto in vitro de fármacos antiparasitarios, el aislamiento, secuenciación y caracterización molecular de cepas de campo y la producción de antígenos específicos para el desarrollo de nuevos métodos de diagnóstico y vacunas.
Envío de muestras para análisis informativos
El Servicio de Vigilancia Sanitaria Equina (SEVISEQ) del centro VISAVET es un laboratorio autorizado para el análisis de Piroplasmosis Equina mediante ELISA de competición, Inmunofluorescencia Indirecta, Fijación de Complemento y PCR (en muestras previas a exportación o movimientos y procedentes de caballos con sospecha o síntomas clínicos).
Para la realización de estos análisis, es necesario que las muestras de suero vengan acompañadas del microchip o UELN del caballo, así como del código REGA de la explotación a la que pertenecen.
Para más información y resolución de dudas acerca de la Piroplasmosis Equina puede dirigirse a:
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Tel.: (+34) 913944096
seviseq@ucm.es
Bibliografía
- Anon. 2014. Equine piroplasmosis. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Chapter 2.5.8.
- Zweygarth E, Vanniekerk C, Just MC, Dewaal DT. 1995. In-Vitro Cultivation of a Babesia Sp from Cattle in South-Africa. Onderstepoort J Vet. 62(2):139-42.
- Holman PJ, Frerichs WM, Chieves L, Wagner GG.. 1993. Culture confirmation of the carrier status of Babesia caballi-infected horses. J Clin Microbiol. 31(3):698-701.
- Posnett ES, Ambrosio RE.. 2009. DNA probes for the detection of Babesia caballi. Parasitology. 102(3):357-65.
- Zweygarth E, van Niekerk CJ, de Waal DT. 1999. Continuous in vitro cultivation of Babesia caballi in serum-free medium. Parasitol Res. 85(5):413-6.
- Zweygarth E, Lopez-Rebollar LM, Nurton J, Guthrie AJ. 2002. Culture, isolation and propagation of Babesia caballi from naturally infected horses. Parasitol Res. 88(5):460-2.
- Schein E, Rehbein G, Voigt WP, Zweygarth E. 1981. Babesia equi (Laveran 1901) 1. Development in horses and in lymphocyte culture. Tropenmed Parasitol. 32(4):223-7.
- Zweygarth E, Just MC, DeWaal DT. 1997. In vitro cultivation of Babesia equi: Detection of carrier animals and isolation of parasites. Onderstepoort J Vet. 64(1):51-6.
- Holman PJ, Chieves L, Frerichs WM, Olson D, Wagner GG. 1994. Babesia equi erythrocytic stage continuously cultured in an enriched medium. J Parasitol. 80(2):232-6.
- Zweygarth E, Just MC, van Niekerk C, de Waal DT. 1997. In vitro cultivation of Babesia equi and its applications. Trop Anim Health Pro. 29(4):60s-s.
- Holman PJ, Hietala SK, Kayashima LR, Olson D, Waghela SD, Wagner GG. 1997. Case report: field-acquired subclinical Babesia equi infection confirmed by in vitro culture. J Clin Microbiol. 35(2):474-6.
- Alhassan A, Govind Y, Tam NT, Thekisoe OM, Yokoyama N, Inoue N, et al. 2007. Comparative evaluation of the sensitivity of LAMP, PCR and in vitro culture methods for the diagnosis of equine piroplasmosis. Parasitol Res. 100(5):1165-8.