Muestras más apropiadas ante una sospecha de enfermedad infecciosa en caballos
Cuando existe una sospecha de enfermedad infecciosa en un caballo, es importante tener en cuenta determinados aspectos básicos de la toma de muestras, de manera que se eviten errores en esta etapa:
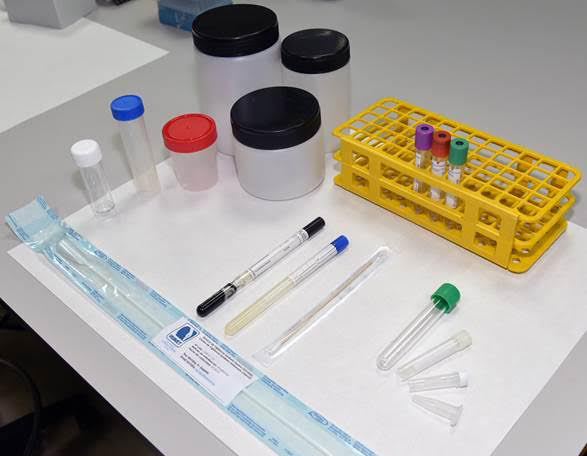
- La elección del material apropiado para la toma de muestras.
- Realizar la toma de muestras en condiciones de limpieza/esterilidad según el caso.
- Las muestras tomadas con el propósito de la detección del agente o del antígeno deben transportarse refrigeradas al laboratorio.
- Las muestras tomadas con el propósito de la detección de anticuerpos (serología) pueden transportarse sin refrigeración.
- Es importantísimo (para evitar errores) realizar una correcta identificación de las muestras.
- Para evitar retrasos en el comienzo de los análisis, es vital adjuntar siempre un formulario de petición de análisis.
En este artículo repasamos las muestras más adecuadas que habría que tomar ante una sospecha de las enfermedades infecciosas más comunes en caballos.
Rinoneumonitis Equina (Herpesvirus Equino tipo 1 y tipo 4)

Enfermedad respiratoria
- Hisopo nasofaríngeo en tubo estéril con salino estéril (PCR).
Sangre completa heparina: Preferentemente 30 ml, mínimo 10 ml (PCR). - Serología: Fijación de Complemento, muestras pareadas, sólo en no vacunados y caballos en contacto no vacunados.
- Hisopo nasofaríngeo en tubo estéril con salino estéril (PCR).
- Sangre completa heparina: Preferentemente 30 ml, mínimo 10 ml (PCR).
- Líquido cefalorraquídeo: Mínimo 1 ml en un tubo de heparina (PCR).
- Muerte/Eutanasia: Cerebro y médula espinal (PCR, Inmunohistoquímica) en duquesa estéril. Lo mismo en formol al 10% para histopatología.
- Serología: Fijación de Complemento, muestras pareadas, sólo en no vacunados y caballos en contacto no vacunados.
- Muestras placenta: Estrella cervical, cuerpo y ambos cuernos uterinos en duquesa estéril. Lo mismo en formol al 10% para histopatología.
- Muestras feto: Hígado, pulmón, bazo, glándula adrenal y timo en duquesa estéril. Lo mismo en formol al 10% para histopatología.
- Serología: No tiene utilidad (yegua, feto). Fijación de Complemento, muestras pareadas, sólo en no vacunados y caballos en contacto no vacunados.
Enfermedad / muerte neonatal
- Enfermedad neonatal: Hisopo nasofaríngeo en tubo estéril con salino estéril (PCR). Sangre completa heparina: Preferentemente 30 ml, mínimo 10 ml (PCR).
- Muerte neonatal: Hígado, pulmón, bazo, glándula adrenal y timo en duquesa estéril. Lo mismo en formol al 10% para histopatología.
- Serología: No tiene utilidad (yegua, feto). Fijación de Complemento, muestras pareadas, sólo en no vacunados y caballos en contacto no vacunados.
Arteritis Vírica Equina

Enfermedad respiratoria / fiebre / edemas
- Hisopo nasofaríngeo en tubo estéril con salino estéril (PCR).
- Sangre completa heparina: Preferentemente 30 ml, mínimo 10 ml (PCR).
- Serología: Seroneutralización, muestras pareadas.
Aborto
- Muestras placenta: Estrella cervical, cuerpo y ambos cuernos uterinos en duquesa estéril. Lo mismo en formol al 10% para histopatología.
- Muestras feto: Hígado, pulmón, timo, líquido peritoneal, líquido pleural. Hígado, pulmón, timo en formol al 10% para histopatología.
- Serología: Utilidad limitada (yegua). Seroneutralización, muestras pareadas.
Muerte / neumonía neonatal
- Neumonía neonatal: Hisopo nasofaríngeo en tubo estéril con salino estéril (PCR). Sangre completa heparina: Preferentemente 30 ml, mínimo 10 ml (PCR).
- Muerte neonatal: Hígado, pulmón, timo, líquido peritoneal, líquido pleural. Hígado, pulmón, timo en formol al 10% para histopatología.
- Serología: Utilidad limitada (yegua, feto). Seroneutralización, muestras pareadas, mejor en caballos en contacto.
Detección sementales portadores
- Suero: Screening mediante ELISA, confirmación positivos/dudosos Seroneutralización.
- Semen: Positivos a Seroneutralización. Fracción rica del eyaculado, refrigerado. Mínimo 1 ml. PCR o aislamiento vírico.
Fiebre del Nilo Occidental (West Nile Virus)
Enfermedad neurológica
- Preferentemente: Suero → ELISA IgM. Muestras pareadas.
- Líquido cefalorraquídeo → ELISA IgM, PCR.
- Sangre completa heparina → PCR [viremia muy corta (2-3 días)].
- Muerte/eutanasia: Líquido cefalorraquídeo, tronco encéfalo, cerebro, médula espinal → PCR.
![]() Si positivo → Declaración obligatoria
Si positivo → Declaración obligatoria
Influenza Equina
Enfermedad aguda
- Hisopo nasofaríngeo en tubo estéril con salino estéril (PCR / NP ELISA).
- Serología: Inhibición de la Hemaglutinación. Muestras pareadas (no es útil en caballos vacunados recientemente – menos de 4 meses).
Anemia Infecciosa Equina
Enfermedad aguda / subaguda / crónica
- Serología: ELISA. Si positivo → Inmunodifusión en Gel de Agar (Test de Coggins).
![]() Si positivo → Declaración obligatoria
Si positivo → Declaración obligatoria
Papera Equina (Streptococcus equi subsp. equi)
Enfermedad aguda
- Hisopo nasofaríngeo en tubo estéril con salino estéril (cultivo + PCR).
- Hisopo / aspirado ganglio abscesado (cultivo + PCR).
Detección de portadores
- 3 Hisopos nasofaríngeos: Tomados en 3 semanas consecutivas (cultivo + PCR).
- Lavado bolsas guturales (cultivo + PCR).
- Serología: ELISA para detectar caballos en contacto afectados (subclínicos), nuevas entradas en una cuadra (cuarentena).
Rhodococcus equi
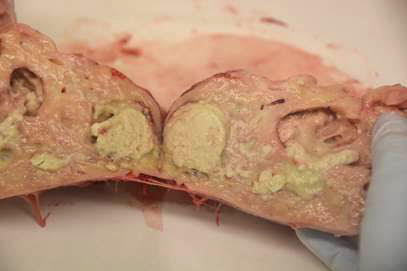
Enfermedad aguda
- Lavado traqueal en tubo estéril (cultivo + PCR vap A).
Muerte / eutanasia
- Hisopo traqueal, pulmón, intestino delgado / contenido intestinal (cultivo + PCR vap A).
Serología
- ELISA para detectar presencia de Rhodococcus equi en una yeguada.
Piroplasmosis Equina (Theileria equi, Babesia caballi)
Enfermedad aguda
- Sangre completa EDTA → PCR.
- Serología: ELISA competición / IFAT en muestras pareadas → mejor que Fijación de Complemento.
Detección de portadores
- Serología (ELISA competición) → Positivos PCR en sangre completa (EDTA) / Cultivo in vitro.
Diarrea por Salmonella spp.
- Heces recogidas de recto (refrigeradas). Preferentemente 3 muestras → Cultivo específico Salmonella.
Diarrea por Clostridium perfringens
- Heces recogidas de recto (refrigeradas) → ELISA enterotoxina Clostridium perfringens.
Un cultivo positivo no implica que Clostridium perfringens es la causa.
Diarrea por Clostridium difficile
- Heces recogidas de recto (refrigeradas) → ELISA Toxina A, B Clostridium difficile.
Un cultivo positivo no implica que Clostridium difficile es la causa.
Otros casos
Por último, en los casos en los que no existe una sospecha clara de un agente en concreto, es vital realizar una correcta anamnesis para descartar la presencia de otros casos en la misma explotación o en explotaciones cercanas. Además, es importante conocer la historia reciente de la explotación: nuevas entradas en la cuadra, salidas a competiciones, cambios en el manejo o en la alimentación, etc. Hay que intentar realizar una lista de diagnósticos diferenciales, pero si aun así el caso no está claro y hay varios agentes que puedan estar produciendo los síntomas, las muestras ideales para un diagnóstico serían: Hisopo nasofaríngeo, sangre en heparina, y suero. Si el caballo ha muerto o se ha sacrificado, las muestras ideales a tomar en la necropsia, tanto en fresco como en formol al 10%, serían: pulmón, hígado, timo, bazo, ganglio, y tejidos del sistema nervioso si el caballo presenta síntomas neurológicos (cerebro, líquido cefalorraquídeo y médula espinal).
Servicio de Vigilancia Sanitaria Equina
Centro de Vigilancia Sanitaria Veterinaria (VISAVET)
Universidad Complutense
Tel.: (+34) 913943999
seviseq@ucm.es
Bibliografía
- Cruz F. 2015. Equine Strangles. VISAVET Outreach Journal. VISAVET Health Surveillance Centre (U.C.M.).
- Burgess, B.A., Morley, P.S. 2014. Managing Salmonella in equine populations. Vet Clin North Am Equine Pract. 30(3): 623-640.
- Diab, S.S., Kinde, H., Moore, J., Shahriar, M.F., Odani, J., Anthenill, L., Songer, G., Uzal, F.A. 2012. Pathology of Clostridium perfringens type C enterotoxemia in horses. Vet Pathol. 49(2):255-263.
- Diab, S.S., Songer, G., Uzal, F.A. 2013. Clostridium difficile infection in horses: a review. Vet Microbiol. 167(1-2):42-49.
- Giguère, S., Cohen, N.D., Chaffin, M.K., Slovis, N.M., Hondalus, M.K., Hines, S.A., Prescott, J.F. 2011. Diagnosis, treatment, control, and prevention of infections caused by Rhodococcus equi in foals. J of Vet Int Med. 25 (6): 1209-1220.
- Equine infectious anemia. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2013. Chapter 2.5.6.
- Equine influenza. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2013. Chapter 2.5.7.
- Equine piroplasmosis. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2013. Chapter 2.5.8.
- Equine rhinopneumonitis. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2013. Chapter 2.5.9.
- Equine viral arteritis. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2013. Chapter 2.5.10.
- Waller, A.S. 2013. Strangles: Taking steps towards eradication. Vet Microbiol. 167(1-2): 50-60.


